👨🎓 Les acides forts⚓
Définition :
Certains acides \(AH\), appelés acides forts, réagissent totalement avec l'eau en libérant des ions oxonium \(H_3O_{\left(aq\right)}^+\) suivant l'équation : \(AH+H_2O_{\left(\ell\right)}\ \longrightarrow\ \ A_{\left(aq\right)}^-+\ H_3O_{\left(aq\right)}^+\)
L'acide \(AH\) n'existe donc pas dans l'eau : il est sous la forme d'ion \(A_{\left(aq\right)}^-\) et d'ion oxonium \(H_3O_{\left(aq\right)}^+\).
Cette équation doit être écrite avec une simple flèche \(\longrightarrow\) pour indiquer que la réaction est totale.
Question⚓
Q1. Écrire les équations modélisant l'apparition des ions oxonium \(H_3O_{\left(aq\right)}^+\) lors de la réaction des acides forts ci-dessous avec l'eau :
Le chlorure d'hydrogène \(HC\ell_{\left(g\right)}\) :
L'acide nitrique \(HNO_{3\ \left(\ell\right)}\) :
L'acide perchlorique \(HC\ell O_{4\ \left(\ell\right)}\) :
Solution⚓
A4-Q1.
Le chlorure d'hydrogène \(HC\ell_{\left(g\right)}\) : \(HC\ell_{\left(g\right)}+H_2O_{\left(\ell\right)}\ \longrightarrow \ H_3O_{\left(aq\right)}^++C\ell_{\left(aq\right)}^-\)
L'acide nitrique \(HNO_{3\ \left(\ell\right)}\) : \(HNO_{3\ \left(\ell\right)}+H_2O_{\left(\ell\right)}\ \longrightarrow \ H_3O_{\left(aq\right)}^++NO_{3\ \left(aq\right)}^-\)
L'acide perchlorique \(HC\ell O_{4\ \left(\ell\right)}\) : \(HC\ell O_{4\ \left(\ell\right)}+H_2O_{\left(\ell\right)}\ \longrightarrow \ H_3O_{\left(aq\right)}^++C\ell O_{4\ \left(aq\right)}^-\)
Question⚓
Q2. On fait réagir \(n\ \mathrm{mol}\) d'un acide fort noté \(AH\) avec de l'eau en excès. Le volume total de la solution obtenue est noté \(V\). Donner l'expression littérale de la concentration \(C_A\) de l'acide \(AH\).
Définition : Conclusion (À SAVOIR)
Un acide \(AH\) est fort si sa réaction avec l'eau est totale : \(AH+H_2O_{\left(\ell\right)}\ \longrightarrow\ \ A_{\left(aq\right)}^-+\ H_3O_{\left(aq\right)}^+\)
Pour une solution d'acide fort de concentration \(C_A\) : \({\fcolorbox{red}{white}{$\color{blue}\mathbf{pH=-\log\ C_A}$}}\).
👨🎓 Les bases fortes⚓
Définition :
Certaines bases \(AH\), appelées bases fortes, réagissent totalement avec l'eau en libérant des ions hydroxyde \(HO_{\left(aq\right)}^-\) suivant l'équation : \(B^-+H_2O_{\left(\ell\right)}\ \longrightarrow\ \ BH_{\left(aq\right)}+\ HO_{\left(aq\right)}^-\)
La base \(B^-\) n'existe donc pas dans l'eau ; elle est sous la forme \(BH\) et d'ion hydroxyde \(HO_{\left(aq\right)}^-\).
Une base forte \(XHO_{\left(s\right)}\) peut aussi libérer des ions hydroxyde \(HO_{\left(aq\right)}^-\) par sa dissolution totale dans l'eau suivant l'équation : \(XHO_{\left(s\right)}\ \longrightarrow\ X_{\left(aq\right)}^++\ HO_{\left(aq\right)}^-\)
Cette équation doit être écrite avec une simple flèche \(\longrightarrow\) pour indiquer que la réaction est totale.
Question⚓
Q5. Écrire les équations modélisant l'apparition des ions hydroxyde \(HO_{\left(aq\right)}^-\) lors de la réaction des bases fortes ci-dessous avec l'eau :
L'ion amidure \(NH_{2\ \left(aq\right)}^-\) :
L'ion méthylate \(CH_3O_{\left(aq\right)}^-\) :
La soude \(NaOH_{\left(s\right)}\) (hydroxyde de sodium) :
Solution⚓
A4-Q5.
L'ion amidure \(NH_{2\ \left(aq\right)}^-\) : \(NH_{2\ \left(aq\right)}^-+H_2O_{\left(\ell\right)}\rightarrow NH_{3\ \left(aq\right)}+HO_{\left(aq\right)}^-\)
L'ion méthylate \(CH_3O_{\left(aq\right)}^-\) : \(CH_3O_{\left(aq\right)}^-+H_2O_{\left(\ell\right)}\rightarrow CH_3OH_{\left(aq\right)}+HO_{\left(aq\right)}^-\)
La soude \(NaOH_{\left(s\right)}\) (hydroxyde de sodium) : \(NaOH_{\left(s\right)}\rightarrow Na_{\left(aq\right)}^++\ HO_{\left(aq\right)}^-\)
Question⚓
Q6. (RÉA) On fait réagir \(\mathrm{mol}\) d'une base forte noté \(B^-\) avec de l'eau en excès. Le volume total de la solution obtenue est noté \(V\). Donner l'expression littérale de la concentration \(C_B\) de la base \(B^-\) .
Rappel :
À \(25\mathrm{^\circ C}\), on a : \(K_e=\left[H_3O^+\right] \times \left[HO^-\right]=1,0\cdot{10}^{-14}\)
\(\log{\frac{A}{B}}=\log{A}-\log{B}\)
Question⚓
Q8. Donner l'expression littérale de la valeur du \(pH\) de la solution en fonction de \(C_B\).
Données :
Définition : Conclusion (À SAVOIR)
Une base \(B^-\) est forte si sa réaction avec l'eau est totale : \(B^-+H_2O_{\left(\ell\right)}\ \longrightarrow\ \ BH_{\left(aq\right)}+\ HO_{\left(aq\right)}^-\)
Pour une solution de base forte de concentration \(C_B\) : \({\fcolorbox{red}{white}{$\color{blue}\mathbf{pH=pK_e+\log{C_B}}$}}\).
👨🎓 Réaction entre un acide fort et une base forte⚓
Définition :
La réaction entre un acide fort et une base forte est une réaction totale d'équation :
\(H_3O_{\left(aq\right)}^+\ +\ HO_{\left(aq\right)}^-\ \longrightarrow\ 2\ H_2O_{\left(\ell\right)}\)
Cette réaction qui peut libérer beaucoup d'énergie thermique (exothermique) et doit être réalisée avec précaution.
💪 Exercice n°1⚓
Un volume \(V=5,0\ \mathrm{mL}\) d'une solution aqueuse \(S\) d'hydroxyde de sodium (base forte) de concentration
\(c=1,5\cdot{10}^{-3}\ \mathrm{mol.L^{-1}}\) est versé dans un volume \(V^\prime=20\ \mathrm{mL}\) d'une solution aqueuse \(S^\prime\) d'acide chlorhydrique (acide fort) de concentration \(c^\prime=7,5\cdot{10}^{-4}\ \mathrm{mol.L^{-1}}\).
Question⚓
Q9. Calculer le \(pH\) de \(S\) et \(S^\prime\).
Réponse à trouver : pH de 11 pour \(S\), et pH de 3,1 pour \(S^\prime\).
Question⚓
Q12. Calculer la quantité de matière n d'ions hydroxyde \(HO_{\left(aq\right)}^-\) apportée par \(S\) et celle \(n^\prime\) d'ions oxonium \(H_3O_{\left(aq\right)}^+\) apportée par \(S^\prime\).
Aide :
La concentration molaire \(C\) et la quantité de matière \(n\) sont reliées par la formule : \(C=\dfrac{n}{V}\) où \(V\) est le volume de la solution.
Réponse à trouver : \(n=7,5\cdot{10}^{-6}\ \mathrm{mol}\) et \(n^\prime = 1,5\cdot{10}^{-5}\ \mathrm{mol}\)
Comme les coefficients stœchiométriques[*] sont de 1 pour les deux réactifs, cela signifie qu'un ion oxonium réagit avec un ion hydroxyde. Si on continue ce raisonnement, \(1\ \mathrm{mol}\) d'ions oxonium réagit avec \(1\ \mathrm{mol}\) d'ions hydroxyde.
Question⚓
Q13. Compte tenu de ce qui précède, calculer la quantité de matière du réactif en excès (celui pour lequel il en reste à la fin).
Réponse à trouver : \(\left(n_{H_3O^+}\right)_{restant}=7,5\cdot{10}^{-6}\ \mathrm{mol}\)
Solution⚓
A4.Q13.
Comme il s'agit d'une réaction 1 pour 1, le réactif en excès est celui pour lequel la quantité de matière est la plus grande, donc c'est \(H_3O^+\) qui est en excès.
Il va alors rester :
\(\left(n_{H_3O^+}\right)_{restant}=n^\prime - n =1,5\cdot{10}^{-5} -7,5\cdot{10}^{-6}=7,5\cdot{10}^{-6}\ \mathrm{mol}\)
Définition : Conclusion (À SAVOIR)
Le réactif en excès est le réactif qui a été introduit en trop grosse quantité : il n'a pas été totalement consommé, il en reste donc encore à la fin de la transformation chimique.
Le réactif limitant est le réactif qui a été introduit en trop faible quantité : il a été totalement consommé durant la transformation chimique, et donc n'est plus présent à la fin.
👨🎓 Les acides faibles et les bases faibles⚓
Définition : Les réactions partielles
Certains acides \(AH\), appelés acides faibles, réagissent partiellement avec l'eau suivant l'équation :
\(AH+H_2O_{\left(\ell\right)}\ \rightleftarrows\ A_{\left(aq\right)}^-+\ H_3O_{\left(aq\right)}^+\)
Certaines bases \(B^-\), appelées bases faibles, réagissent partiellement avec l'eau suivant l'équation :
\(B^-+H_2O_{\left(\ell\right)}\ \rightleftarrows\ BH_{\left(aq\right)}+\ HO_{\left(aq\right)}^-\)
À la fin de la réaction, les réactifs et les produits sont simultanément présents. Une réaction partielle (ou limitée) conduit à un état d'équilibre.
Ces équations doivent être écrites avec une double flèche \(\rightleftarrows\) pour indiquer que les réactions sont partielles.
Complément : Document n°1 : La constante d'acidité
Soit un couple acide-base faible \(AH_{\left(aq\right)}\ / \ A_{\left(aq\right)}^-\) associé à la réaction d'équation : \(AH_{\left(aq\right)}+H_2O_{\left(\ell\right)}\ \rightleftarrows \ A_{\left(aq\right)}^-+\ H_3O_{\left(aq\right)}^+\)
On définit une grandeur \(K_a\) sans unité appelée constante d'acidité telle que :
Il est d'usage de poser : \({\fcolorbox{blue}{white}{$\mathbf{pK_a=-\log{\ K_a}}$}}\)
Où :
\(\mathbf{K_a}\) : Constante d'acidité (sans unité)
\(\mathbf{\Big[H_3O^+\Big]}\) : concentration en ion oxonium \(\left(\mathrm{mol.L^{-1}}\right)\)
\(\mathbf{\Big[A^-\Big]}\) : concentration de la forme basique \(\left(\mathrm{mol.L^{-1}}\right)\)
\(\mathbf{\Big[AH\Big]}\) : concentration de la forme acide \(\left(\mathrm{mol.L^{-1}}\right)\)
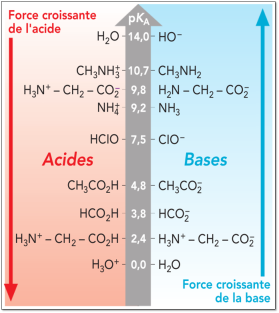
Plus le \(pK_a\) du couple est grand (ou plus la constante d'acidité est petite), moins l'acide se dissocie dans l'eau.
En effet, plus \(\Big[AH\Big]\) est grand par rapport à \(\Big[A^-\Big]\) , plus la constante \(K_a\) est petite. Ainsi, plus le \(pK_a\) d'un acide est grand, plus cet acide est faible.
Complément : Document n°2 : Valeurs de pKa à 25°C
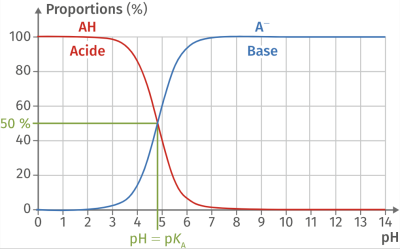
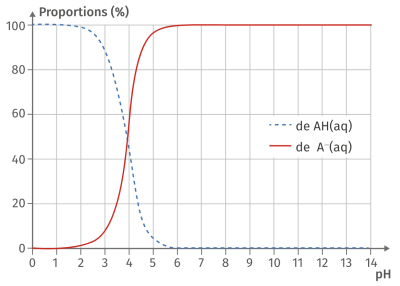
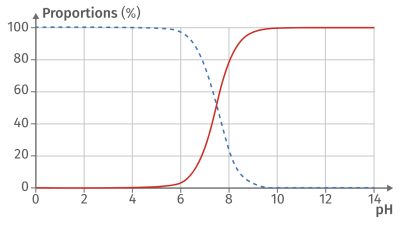
Complément : Document n°3 : Diagramme de distribution
Attention : Pas de malentendu
Lorsqu'une réaction est limitée, on dit qu'elle atteint un état d'équilibre. Attention, cet état d'équilibre est dynamique, c'est-à-dire que la réaction directe et la réaction inverse se produisent simultanément, à la même vitesse.
Raisonner sur la constante d'acidité ou sur le \(pK_a\) amène à la même conclusion. L'une se base sur des puissances de 10 négatives tandis que l'autre est comprise entre 0 et 14 dans l'eau.
La dangerosité d'un acide n'est pas liée à sa force, mais à sa concentration en solution.
Complément : Supplément numérique 🎥
Vous pouvez visionner cette vidéo (clic ici) sur la constante d'acidité (ou QR-Code). Lien : https://p-berger.canoprof.fr/eleve/Ressources/VIDEO-Constante-acidite.mp4 |
|
(Source : C Ciachera sur youtube)
Question⚓
Q16. D'après la définition du \(K_a\) dans le Doc.1, établir l'expression littérale du \(pH\) d'une solution d'acide faible \(AH_{\left(aq\right)}\) en fonction de son \(pK_a\), de sa concentration \(\Big[AH\Big]\) et de la concentration de sa base conjuguée \(\Big[A^-\Big]\).
Solution⚓
A4-Q16.
Question⚓
Q17. Que peut-on dire de la concentration de l'acide faible \(\Big[AH\Big]\) et de sa base conjuguée \(\Big[A^-\Big]\) lorsque \(pH=pK_a\) ?
Aide : utiliser le rappel ci-contre →
\(\Large{\color{blue}\textsf{Rappels sur les log :}}\)
\(\large{\log{\ (A\times B)}=\log{A}+\log{B}}\)
\(\large{\log{1}=0}\)
\(\large{\textsf{si } x<1 \textsf{ alors } \log{x}<0}\)
\(\large{\textsf{si } x>1 \textsf{ alors } \log{x}>0}\)
Solution⚓
A4-Q17.
\(pH=pK_a\), on a :
\[\begin{array}{rcl} {-\log{\ \dfrac{\Big[AH\Big]}{\Big[A^-\Big]}}=0 } & \Longleftrightarrow & { \dfrac{\Big[AH\Big]}{\Big[A^-\Big]}=1 } \\ \\ & \Longleftrightarrow & {\fcolorbox{red}{white}{$ \hspace{2mm} {\mathbf{\color{red} \Big[AH\Big]=\Big[A^-\Big] } } \hspace{2mm} $}} \end{array} \]
Question⚓
Q18. Que peut-on dire de la concentration de l'acide faible \(\Big[AH\Big]\) et de sa base conjuguée \(\Big[A^-\Big]\) lorsque \(pH>pK_a\) ?
Q19. Que peut-on dire de la concentration de l'acide faible \(\Big[AH\Big]\) et de sa base conjuguée \(\Big[A^-\Big]\) lorsque \(pH<pK_a\) ?
Solution⚓
A4-Q18.
\(pH>pK_a\), on a :
A4-Q19.
\(pH<pK_a\), on a :
Question⚓
Définition : Conclusion (À SAVOIR)
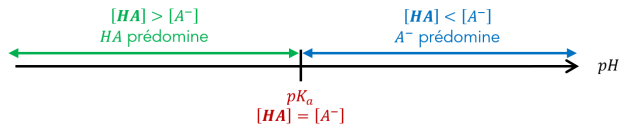
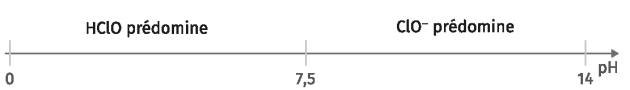
Le diagramme de prédominance montre graphiquement les espèces d'un couple acide-base qui sont majoritairement prédominantes à une valeur de \(\mathbf{pH}\) donnée.
Quand le \(pH\) est égale au \(pK_a\) d'un couple, les concentrations de la forme acide et de la forme basique de ce couple sont égales.
Lorsque le pH est inférieur au \(pK_a\), la forme acide prédomine.
Lorsque le pH est supérieur au \(pK_a\), la forme basique prédomine.
🏋️♂️ Exercices⚓
💪 Exercice n°2 :⚓
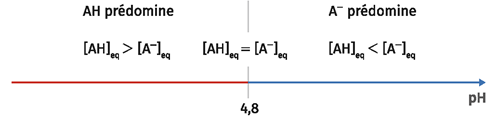
Le \(pK_a\) du couple acide éthanoïque / ion éthanoate que l'on notera \(AH\ / \ A^-\) vaut 4,8.
💪 Exercice n°3 : Couple acide lactique/ion lactate⚓
Question⚓
Q25. Utiliser les résultats de la question précédente pour déterminer à nouveau le \(pK_a\). Comparer cette nouvelle valeur calculée à celle déterminée graphiquement à la question Q23.
Aide : il faut utiliser les % des proportions des deux espèces par rapport à la concentration totale, et utiliser la relation entre le pH et le pKa.
Solution⚓
A4-Q25.
D'après la question précédente :
\(\Big[AH\Big]=0,90\times C_{totale}\)
\(\Big[A^-\Big]=0,10\times C_{totale}\)
\(\Big[H_3O^+\Big]=10^{-pH}=10^{-3}\ \mathrm{mol.L^{-1}}\)
Ainsi : \(K_a=\dfrac{\Big[A^-\Big]\times \Big[H_3O^+\Big]}{\Big[AH\Big]}=\dfrac{0,10\times C_{totale}\times 10^{-3}}{0,90\times C_{totale}}=1,1\cdot 10^{-4}\)
On a donc : \(pK_a=-\log \ K_a=-\log {\ \left(\ 1,1\cdot 10^{-4}\ \right) }=3,9586...\approx 4\)
On retrouve bien la valeur du \(pK_a\) déterminée graphiquement précédemment.