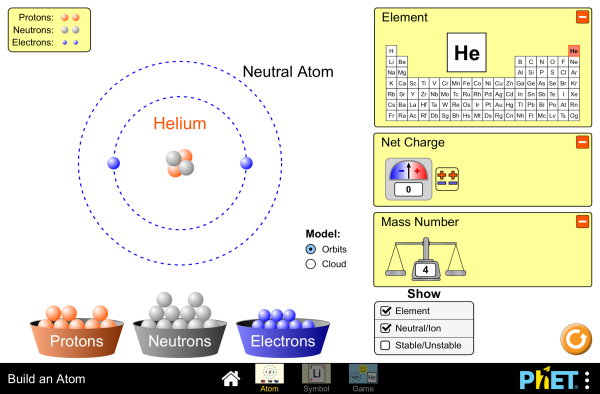
Pour répondre aux questions, vous utiliserez à la fois le logiciel de simulation construire un atome ainsi que les différentes données de l'activité préparée à la maison
Vous expliquerez les observations que vous avez faites de la simulation, puis la conclusion que l'on peut en tirer.
Simulateur en ligne
L'application permet de simuler des atomes en ajoutant les constituants de base d'un atome un à un. Pour cela, il faut glisser les différents constituant vers la croix rouge.
À droite, il y a 3 panneaux que l'on peut ouvrir ou fermer grâce au symbole +. Le panneau Élément correspond au tableau périodique de Mendeleïev. Nous verrons les autres panneaux par la suite.
Lien vers la simulation : https://phet.colorado.edu/fr/simulations/build-an-atom
→ Cliquez droit sur l'image ou sur le lien puis Ouvrir le lien dans un nouvel onglet.
Placer 3 neutrons et 3 électrons sur la croix rouge. Le nombre de neutrons et d'électrons restera fixe. Tout en ajoutant des protons un à un jusqu'au nombre de 10, observer le tableau périodique.
Cliquer sur le bouton Tout remettre à zéro en bas à droite, en pensant à remettre les paramètres que l'on avait défini précédemment. Reprendre cette simulation en inversant le rôle des neutrons et des protons c'est à dire que l'on place 3 protons au départ et on augmente le nombre de neutrons jusqu'à 10.
Définition : Isotope
Deux noyaux sont des isotopes s'ils possèdent le même nombre de protons (même élément chimique) mais un nombre différent de neutrons.
Exemple : Carbone 12 et carbone 14
Le carbone est l'élément numéro 6 du tableau périodique il possède donc 6 protons.
Le carbone 12 possèdent 12 nucléons, d'où \(12-6=6\) neutrons.
Le carbone 14 possèdent 14 nucléons, d'où \(14-6=8\) neutrons.
Ces deux noyaux sont donc des isotopes.
Question⚓
Q3. Construire deux isotopes du lithium (\(Li\)) et donner les différentes particules qui les composent.
Construire un noyau d'hélium avec 2 protons et 1 neutron. Ouvrir le panneau Bilan électrique. Ajouter des électrons jusqu'à en avoir 4.
Définition : Atome ou ion ?
Un élément chimique est
un atome s'il est neutre ;
un ion s'il est chargé.
Réinitialiser le logiciel. Ouvrir le panneau Nombre de masse. Ajouter des protons, des neutrons et des électrons en observant le nombre de masse.
Cliquer sur le bouton Symbole tout en bas de la page. Ajouter des protons, des neutrons et des électrons.
Question⚓
Q6. En observant les différents panneaux, expliquez comment on peut calculer les différentes lettres (\(\mathrm{A}\), \(\mathrm{Z}\) et \(\mathrm{C}\)) du symbole chimique \(^\mathrm{A}_\mathrm{Z}X^\mathrm{C}\) .
Solution⚓
A3.Q6.
\(\mathrm{Z}\) correspond au nombre de protons ;
\(\mathrm{A}\) correspond au nombre de masse, il faut donc ajouter le nombre de protons et de neutrons ;
\(\mathrm{C}\) correspond à la charge de l'ion et correspond à la différence du \(\text{nombre de protons} - \text{nombre d'électrons}\).
Attention :
Le véritable symbole du noyau est \(^A_ZX\). Les électrons n'étant pas dans le noyau on n'écrit pas la charge électrique \(\mathrm{C}\) dans ce symbole.
Construire un atome d'hélium 4.
Question⚓
Q8. Recenser le nombre de protons, neutrons et électrons de votre atome ou ion d'hélium. En supposant que la masse d'un atome correspond à la somme des masses des différentes particules calculer la masse en kg de votre élément hélium.
Utiliser la table de l'activité documentaire Un peu de théorie
Solution⚓
A3.Q8.
L'hélium 4 possède 2 protons et 4 nucléons (donc \(4-2 = 2\) neutrons). Étant neutre il possède 2 électrons.
Calcul de la masse de l'atome :
\(m_\mathrm{atome}=2\times m_\mathrm{proton}+2\times m_\mathrm{neutron}+2\times m_\mathrm{electron}\)
\(m_\mathrm{atome}=2\times 1,672\times 10^{-27}+2\times 1,674\times 10^{-27}+2\times 9,109\times 10^{-31}\)
\(\color{blue}m_\mathrm{atome}=6,69\times 10^{-27}\ \mathrm{kg}\)
Question⚓
Q9. Est-ce nécessaire de prendre en compte la masse des électrons ? Justifier.
Solution⚓
A3.Q9.
Un électron étant environ 2000 plus léger qu'un nucléon, la masse d'un électron est négligeable (sauf si l'on souhaite une précision inférieure au millième).
(On pourrait calculer la masse du noyau et la masse des électrons et comparer ces deux valeurs pour se rendre compte que celle des électrons est vraiment très faible comparée à celle du noyau.)
Complément : Pour aller plus loin
Maintenant, vous pouvez vous auto-évaluer grâce à des jeux. Pour cela, dans le logiciel de simulation, cliquer sur l'onglet Jeu en bas de la fenêtre. Sélectionner un des quatre jeux proposés en sélectionnant le niveau. Une fois le jeu terminé passer à un autre niveau.