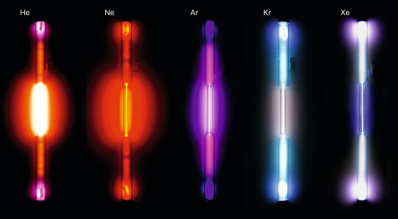
Problématique
Les gaz nobles, autrefois appelés gaz rares, sont les éléments chimiques de la dernière colonne du tableau périodique (groupe 18). Ils sont chimiquement peu réactifs et cette inertie chimique est mise à profit dans de nombreuses applications, en particulier dans le domaine de l'éclairage.
Quelle propriété atomistique confère cette inertie chimique aux gaz nobles ?
Complément : Document n°1 - Présentation des gaz nobles
Il existe à l'état naturel six gaz nobles : l'hélium \(He\), le néon \(Ne\), l'argon \(Ar\), le krypton \(Kr\), le xénon \(Xe\) et le radon \(Ra\). Ces gaz ont la particularité d'être très peu réactifs, on dit qu'ils sont stables. On les a longtemps nommés gaz inertes avant que l'on ne découvre quelques composés du xénon et du krypton.
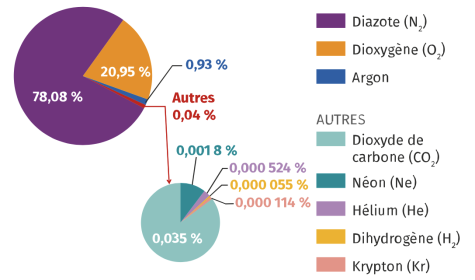
L'argon est le gaz noble le plus présent dans notre atmosphère (0,93 %), c'est le troisième gaz entrant dans la composition de notre atmosphère. Aussi l'appellation de gaz rares autrefois courante est-elle peu appropriée !
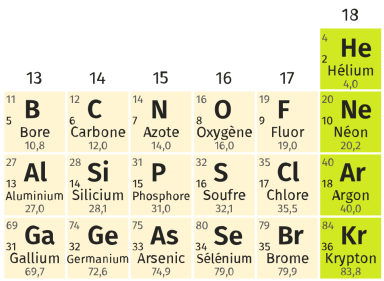
Complément : Document n°2 - Les gaz nobles dans le tableau périodique
Colonnes 13 à 18 du tableau périodique des éléments :
Complément : Document n°3 - Répartition des gaz dans l'atmosphère
Complément : Bonus - L'Hélium (inutile pour les questions, mais utile pour la culture générale)
Et visionnez la vidéo de la chambre de l'hélium, particulièrement froide : https://www.lumni.fr/video/l-helium
___________________________________________________________________________________________________________
Questions⚓
Question⚓
Q3. [Doc. 1, 2 et 3] Expliquer les raisons pour lesquelles les appellations de gaz inerte et gaz rare ont été progressivement abandonnées au profit de gaz noble.