❓ Problématique
On souhaite étudier la réaction qui se produit dans l’organisme, entre l’hydrogénocarbonate et les ions hydrogène \(\ce{H+}\) responsable de l’acidité.
📄 Documents⚓
Complément : [Document n°1] : Présentation de l’hydrogénocarbonate de sodium
L’hydrogénocarbonate de sodium, aussi appelé injustement bicarbonate de sodium (ou de soude), se présente sous la forme d’une poudre blanche. Sa formule chimique est : \(\ce{NaHCO_{3\ (s)}}\).
Il est biodégradable, non toxique pour l’environnement et l’organisme. Peu de boissons contiennent du bicarbonate hormis les eaux gazeuses comme St-Yorre, Badoit… En revanche il est vendu en grandes surfaces.
Il adoucit l'eau des bains, calme la fatigue et détend les muscles. Conseillé pour les sportifs puisqu'il favorise la récupération.

Complément : [Document n°2] : L’hydrogénocarbonate de sodium pour « plus de vitesse »…

Les athlètes professionnels le savent depuis longtemps, mais les scientifiques viennent tout juste de le prouver : ce bon vieux produit peut accroitre les performances sportives !
Ses effets sur l'endurance et sur la vitesse ont été validés après une étude réalisée par des chercheurs de l'université Loughborough (Angleterre). Celle-ci vient a montré que sur 9 nageurs qui avaient pris de l'hydrogénocarbonate de sodium avant une compétition sportive, 8 ont réduit leur temps de nage.
Lors d'un exercice anaérobique intense, les muscles produisent de l'acide lactique, qui libère des ions (ions acides) dans le sang. Le pH du sang diminue. L'hydrogénocarbonate de sodium est une base et en réagissant avec les ions \(\ce{H+}\), elle rééquilibre le pH du sang.
Cela permet donc aux muscles de fatiguer moins rapidement. La récupération est plus rapide.
Ce n'est cependant pas une substance miraculeuse : cela permet de gagner quelques secondes et seuls les athlètes de haut niveau, dans des épreuves rapides, sentiront véritablement la différence.
Complément : [Document n°3] : Mode d’emploi de l’hydrogénocarbonate de sodium
Absorber la dose en buvant une solution d'eau bicarbonatée avant l'effort, progressivement et sur une durée de 1 à 2 h avant l'effort.
Dosage : \(0,3\ \mathrm{g/kg}\) de masse corporelle et par jour
Mise en garde : l'absorption de quantités de bicarbonate trop importantes sur des durées trop courtes peut entrainer des nausées et des vomissements.
🧮 Équation de réaction⚓
La transformation chimique étudiée est celle se produisant entre l’hydrogénocarbonate de sodium, solide blanc de formule \(\ce{NaHCO_{3\ (s)}}\) et l’acide chlorhydrique, de formule \(\left(\ce{H^+_{\ (aq)} +} \mathrm{C\ell}^-_{\ (aq)} \right)\). En effet, en milieu aqueux, l’hydrogénocarbonate de sodium réagit avec les ions \(\ce{H^+_{\ (aq)}}\) pour former de l’eau, des ions \(\ce{Na^+_{\ (aq)}}\) et un gaz très connu (celui que nous expirons).
🧪 Mise en œuvre expérimentale⚓
On dispose du matériel suivant :
Erlenmeyer de \(100\ \mathrm{mL}\)
Éprouvette graduée de de \(20\ \mathrm{mL}\)
Balance, coupelle et spatule
Ballon de baudruche
Hydrogénocarbonate de sodium en poudre
Solution d’acide chlorhydrique de concentration \(C=0,1\ \mathrm{mol.L^{-1}}\)
Bleu de bromothymol (BBT)
Eau de chaux
Question⚓
Q4. À partir du matériel disponible, proposer un protocole (sans mesures précises pour le moment), permettant :
de faire réagir des quantités connues d’acide chlorhydrique et d’hydrogénocarbonate de sodium ;
de montrer que le pH de la solution évolue au cours de la réaction ;
de recueillir puis d’identifier le gaz formé.
Vous rédigerez votre protocole en l’accompagnant d’un schéma légendé du montage.
Aide : le BBT (bleu de bromothymol) est un indicateur de présence des ions \(\ce{H+}\)
Attention :
![]()
Il ne faudra surtout pas mouiller le ballon de baudruche, sinon la poudre d’hydrogénocarbonate accrocherait sur les parois du ballon.
Q5. L’un après l’autre, réaliser les trois mélanges du tableau ci-dessous en suivant le protocole donné :
Mélange 1 | Mélange 2 | Mélange 3 | |
|---|---|---|---|
Hydrogénocarbonate de sodium | \(1,0\ \mathrm{g}\) | \(1,0\ \mathrm{g}\) | \(1,0\ \mathrm{g}\) |
Acide chlorhydrique | \(5,0\ \mathrm{mL}\) | \(10\ \mathrm{mL}\) | \(20\ \mathrm{mL}\) |
👀 Observations⚓
Question⚓
Q6. À partir des observations réalisées, compléter le tableau suivant :
| Mélange 1 | Mélange 2 | Mélange 3 |
|---|---|---|---|
Couleur de la solution dans l’état initial | |||
Couleur de la solution dans l’état final | |||
Description du volume de gaz formé | |||
Reste-t-il du solide dans l’état final ? |
🖍 Exploitation⚓
Complément : Quelques appels
\[\begin{array}{lcl} {\fcolorbox{red}{white}{$ {\large \ \ \ \mathbf{ n=\dfrac{m}{M} } \ \ \ } $}} & \large \text{ avec :} & \begin{cases} {\large\ \mathbf{n}\ \text{ :} } & {\large \text{quantité de matière en } \mathbf{mol} }\\ {\large\ \mathbf{m}\ \text{ :} } & {\large \text{la masse du corps en } \mathbf{g} } \\ {\large\ \mathbf{M}\ \text{ :} } & {\large \text{la masse molaire } \mathbf{g.mol^{-1}} } \end{cases} \end{array}\]
\[\begin{array}{lcl} {\fcolorbox{red}{white}{$ {\large \ \ \ \mathbf{ C=\dfrac{n}{V} } \ \ \ } $}} & \large \text{ avec :} & \begin{cases} {\large\ \mathbf{C}\ \text{ :} } & {\large \text{concentration molaire en } \mathbf{mol.L^{-1}} } \\ {\large\ \mathbf{n}\ \text{ :} } & {\large \text{quantité de matière en } \mathbf{mol} }\\ {\large\ \mathbf{V}\ \text{ :} } & {\large \text{volume de la solution en } \mathbf{L} } \end{cases} \end{array}\]
Données : Masse molaire atomique
\(\large M_{\ce{H}}=1,00\ \mathrm{g.mol^{-1}}\)
\(\large M_{\ce{C}}=12,0\ \mathrm{g.mol^{-1}}\)
\(\large M_{\ce{O}}=16,0\ \mathrm{g.mol^{-1}}\)
\(\large M_{\ce{Na}}=23,0\ \mathrm{g.mol^{-1}}\)
Question⚓
Q7. Comment prouver qu’une réaction chimique a bien eu lieu dans l’erlenmeyer ?
Question⚓
Q8. Quels sont les réactifs et les produits de cette réaction chimique?
Question⚓
Q9. Quelle conclusion peut-on établir quant aux valeurs de masses relevées ?
Question⚓
Q10. Quelle serait l’évolution de la masse si le ballon de baudruche était absent ? Pourquoi ?
Question⚓
Q11. Que peut-on déduire grâce à la couleur finale de la solution dans les mélanges 1 et 3 ?
Question⚓
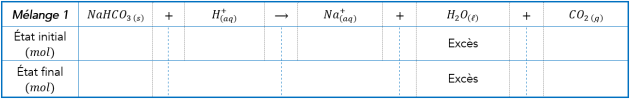
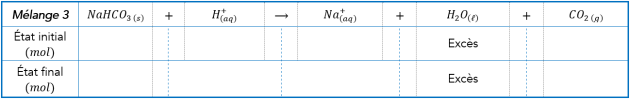
Q.12 Calculer les quantités de matière en mole des réactifs utilisés dans chaque transformation. Bien justifier les calculs.
C’est ce qu’on appelle « réaliser le bilan matière à l’état initial ».
Question⚓
Question⚓
Q14. En raisonnant sur les quantités de réactifs introduites ainsi que sur la signification de l’équation chimique, compléter l’état final des deux tableaux précédents. Est-ce en accord avec ce que vous avez observé ?
Définition 📌 (à savoir)
Question⚓
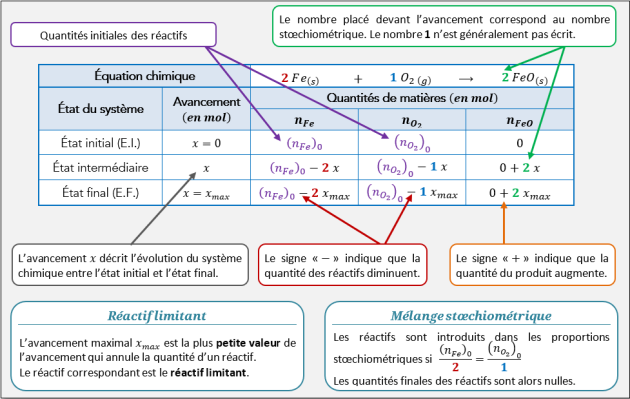
Q16. De quoi dépend l’arrêt d’une réaction chimique ? Déterminer, dans chaque cas, le réactif limitant.
👨🎓 Notion d’avancement d’une réaction chimique⚓
Question⚓
Q17. Complétant le tableau du mélange 2 ci-dessous en utilisant le Doc.5.
Il faudra :
déterminer l’avancement maximal ;
déterminer le réactif limitant ;
faire le bilan matière à l’état final.
Mélange 2 | |||||
|---|---|---|---|---|---|
État initial \(\left( \mathrm{mol} \right)\) | Excès | ||||
État final \(\left( \mathrm{mol} \right)\) | Excès | ||||
Question⚓
Q18. Qu’est-ce qu’un mélange stœchiométrique ? Écrire la réponse dans la zone de définition ci-dessous.
Définition :
Question⚓
Q19. Quel volume d’acide chlorhydrique aurait-il fallu introduire pour qu’on ait un mélange stœchiométrique ?
Solution⚓
A2-Q19.
Pour avoir un mélange stœchiométrique, il faudrait qu’on ait : \(\dfrac{n_{\ce{H+}}}{1}=\dfrac{n_{\ce{NaHCO3}}}{1}\).
Donc \(n_{\ce{H+}}=n_{\ce{NaHCO3}}=1,2\cdot{10}^{-2}\ \mathrm{mol}\), ce qui correspond à un volume :
\(n_{\ce{H+}}=C\times V\ \Longleftrightarrow V=\dfrac{n_{\ce{H+}}}{C}=\dfrac{1,2\cdot{10}^{-2}}{1,0}\color{blue}=1,2\cdot{10}^{-2}\ \mathrm{L}=12\ \mathrm{mL}\)