Attention :
Cette activité est une activité expérimentale de chimie utilisant des acides et des bases.
|
|
|
|
|
|
→ Vous devrez manipuler en mettant des EPI tels qu'une blouse, des gants et des lunettes de protection.
Les méthodes de mesure d'un pH⚓
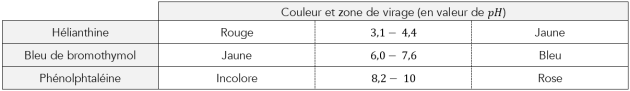
Complément : Document n°1 : Les indicateurs colorés
Complément : Document n°2 : Le papier pH
Le papier pH est un papier absorbant imbibé d'un mélange d'indicateurs colorés qui permet de déterminer le pH d'une solution instantanément en fonction de sa couleur.

Complément : Document n°3 : Le pH-mètre
Un pH-mètre, relié à une sonde pH-métrique, est un appareil qui permet de mesurer le pH d'une solution aqueuse. Avant d'être utilisé, un pH-mètre doit être étalonné, généralement avec deux solutions étalons de pH connu appelées solutions tampons.
Une fiche méthode est proposée pour bien l'utiliser.

Question⚓
Q1. Proposer et réaliser un protocole expérimental permettant de mesurer par trois méthodes différentes le pH d'une solution inconnue.
Solution⚓
A3-Q1.
Mode opératoire simplifié :
Verser \(\approx25\ mL\) de solution inconnue dans un bécher.
En utilisant un agitateur en verre, placer une goutte de cette solution sur un bout de papier pH placé sur une coupelle.
Lire la valeur du pH à l'aide du nuancier de couleur.
Étalonner le pH-mètre en s'aidant de la fiche méthode, puis mesurer le pH à l'aide de la sonde. Rincer ensuite l'électrode à l'eau et remettre son capuchon.
Dans 3 tubes à essai quelques mL de la solution inconnue, puis à l'aide d'une pipette introduire quelques gouttes d'un seul indicateur coloré dans chacun des tubes à essai.
Question⚓
Q2. Schématiser et comparer les trois méthodes du point de vue de leur rapidité de mise en œuvre et de leur précision.
Solution⚓
A3-Q2.
La méthode la plus rapide est le papier pH, mais c'est aussi l'une des moins précise puisqu'on obtient un encadrement assez large.
La méthode avec l'indicateur coloré n'est pas une méthode très rapide, et n'est pas non plus précise car on obtient un encadrement encore plus large qu'avec le papier pH.
L'utilisation du pH-mètre est donc la méthode la plus précise mais elle prend le plus de temps à cause de l'étalonnage de l'appareil avant toute mesure.
Distinguer un acide fort d'un acide faible⚓
Complément : Document n°4 : Rappels sur la définition du pH
Le pH est une grandeur sans unité qui quantifie l'acidité d'une solution aqueuse et est défini par la relation suivante :
Cette relation n'est est valable que pour \(\mathrm{\Big[H_3O^+\Big]<0,10\ \mathrm{mol.L^{-1}}}\).
Complément : Document n°5 : Les théories de Roger
Roger, grand fan de chimie, rédige un petit paragraphe pour un magazine scientifique sur la réaction d'un acide avec l'eau :
« La réaction d'un acide avec l'eau est une réaction violente et très rapide ! Les acides réagissent en effet totalement avec l'eau, voici quelques exemples :
Pour calculer le pH d'une solution d'acide, il suffit de connaître la concentration \(C\) de l'acide dans la solution :
Exemple :
\(\large{ C=\mathrm{\Big[HC\ell\Big]=\Big[CH_3COOH\Big]=\Big[H_3O^+\Big]} } \quad \textsf{et} \quad \large{ \mathrm{pH=-\log{\ \Big[H_3O^+\Big]}=-\log{\ C}} }\) »
On dispose de deux solutions d'acide chlorhydrique \(HC\ell_{\left(aq\right)}\) et d'acide éthanoïque \(CH_3COOH_{\left(aq\right)}\) de concentration \(C=0,1\ \mathrm{mol.L^{-1}}\) et d'un pH-mètre.
→ Mesurer le pH de ces deux solutions à l'aide du pH-mètre.
→ Noter vos résultats.
Question⚓
Q3. D'après l'hypothèse de Roger, quelle devrait-être la valeur de la concentration \(\Big[H_3O^+\Big]\) en ions oxonium de ces deux solutions.
Question⚓
Q4. À partir de la valeur du pH mesuré, calculer les concentrations \(\Big[H_3O^+\Big]\) en ions oxonium de ces deux solutions.
Question⚓
Q5. Comparer ces valeurs calculées avec celles déterminées à la question Q3 et conclure quant-à la réaction totale ou non avec l'eau.
Solution⚓
A3-Q5.
Pour l'acide chlorhydrique : La valeur calculée est égale (ou environ égale) à la valeur indiquée de la concentration de la solution.
En revanche, pour l'acide éthanoïque : la valeur calculée est plus faible que la valeur indiquée de la concentration de la solution.
L'acide chlorhydrique réagit donc totalement avec l'eau, mais pas l'acide éthanoïque qui ne réagit que partiellement avec l'eau car la concentration en ions oxonium est bien plus faible que celle attendue s'il réagissait totalement avec l'eau.
Question⚓
Q6. En déduire une méthode permettant d'identifier un acide fort et un acide faible.
Réaction entre un acide fort et une base forte⚓
Complément : Document n°6 : Acide fort et base forte
Un acide est fort si sa réaction avec l'eau est totale. L'acide est entièrement présent sous forme d'ions \(H_3O_{\left(aq\right)}^+\). L'acide chlorhydrique est un exemple d'acide fort.
Une base est forte si sa réaction avec l'eau est totale. La base est entièrement présente sous forme d'ions hydroxyde \(HO_{\left(aq\right)}^-\). L'hydroxyde de sodium (soude) est un exemple de base forte.
L'ion oxonium et l'ion hydroxyde réagissent selon une réaction totale et instantanée d'équation :
\(\mathrm{H_3O_{\left(aq\right)}^+\ +\ HO_{\left(aq\right)}^-\ \longrightarrow\ 2\ H_2O_{\left(\ell\right)}}\)
Complément : Document n°7 : Le calorimètre
Un calorimètre est une enceinte thermodynamiquement isolée empêchant tout échange de chaleur avec le milieu extérieur.
Le calorimètre permet ainsi de mesurer les échanges de chaleurs mettant en jeu des changements d'état ou des réactions chimiques se déroulant à l'intérieur de l'enceinte.
Si les calorimètres ne sont pas disponibles, il faudra utiliser un bécher posé sur une plaque de polystyrène pour isoler ce dernier de la paillasse, et entourer le bécher de papier aluminium pour limiter les pertes thermiques par rayonnement.
La manipulation ne nécessite pas une grande précision sur la mesure de la température, car seule sa variation est mesurée.

Définition : Endothermique et exothermique (À SAVOIR)
Une réaction chimique est dite endothermique si elle est accompagnée d'une absorption de chaleur.
Une réaction chimique est dite exothermique si elle est accompagnée d'une production de chaleur.
Rappel : Énergie libérée par une réaction chimique (À SAVOIR)
Avec :
\(E\) : énergie libérée \(\left(\ \mathrm{J}\ \right)\)
\(m\) : masse du système réactionnel \(\left(\ \mathrm{g}\ \right)\)
\(c\) : capacité calorifique du milieu \(\left(\ \mathrm{J.g^{-1}.K^{-1}}\right)\)
\(\theta_i\) : température initiale \(\left(\mathrm{K}\ ou\ \mathrm{^\circ C}\right)\)
\(\theta_f\) : température finale \(\left(\mathrm{K}\ ou\ \mathrm{^\circ C}\right)\)
Mélange n°1 - Mode opératoire
Dans un calorimètre, verser avec précaution, \(50\ \mathrm{mL}\) d'une solution d'acide chlorhydrique de concentration \(C=1,0\ \mathrm{mol.L^{-1}}\).
Mesurer la température initiale \(\theta_i\) de la solution.
Avec précaution, ajouter dans le calorimètre \(50\ \mathrm{mL}\) d'une solution d'hydroxyde de sodium de concentration \(C=1,0\ \mathrm{mol.L^{-1}}\).
Agiter quelques secondes et mesurer la température finale \(\theta_f\) du mélange.
Mélange n°2 - Mode opératoire
Après avoir rincé le calorimètre, recommencer l'expérience précédente avec des solutions d'acide chlorhydrique et d'hydroxyde de sodium de concentration \(C^\prime=0,10\ \mathrm{mol.L^{-1}}\).
Question⚓
Q7. Compléter les deux 1ères colonnes de tableau récapitulatif ci-dessous :
\(\theta_i\ \left(\mathrm{^\circ C}\right)\) | \(\theta_f\ \left(\mathrm{^\circ C}\right)\) | \(E\ \left(\ \mathrm J\ \right)\) | |
|---|---|---|---|
Mélange 1 \(C=1,0\ \mathrm{mol.L^{-1}}\) | |||
Mélange 2 \(C=0,1\ \mathrm{mol.L^{-1}}\) |
Solution⚓
A3-Q7.
\(\theta_i\ \left(\mathrm{^\circ C}\right)\) | \(\theta_f\ \left(\mathrm{^\circ C}\right)\) | \(E\ \left(\ \mathrm J\ \right)\) | |
|---|---|---|---|
Mélange 1 \(C=1,0\ \mathrm{mol.L^{-1}}\) | \(\color{blue}22,8\) | \(\color{blue}26,8\) | |
Mélange 2 \(C=0,1\ \mathrm{mol.L^{-1}}\) | \(\color{blue}22\) | \(\color{blue}23\) |
L'énergie doit être calculée avec la formule du rappel précédent.
Question⚓
Q9. Calculer l'énergie thermique libérée par la réaction pour les deux mélanges. On assimilera la masse du mélange réactionnel à la masse du même volume d'eau et on suppose \(c=c_\mathrm{eau}=4,180 \; \mathrm{J.g^{-1}.K^{-1}}\).