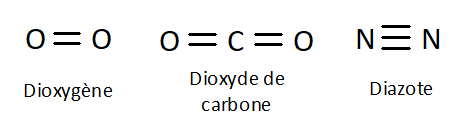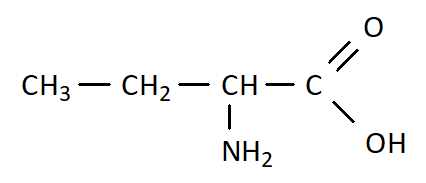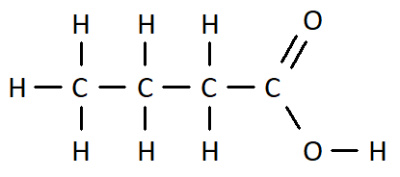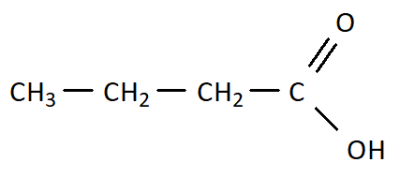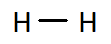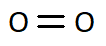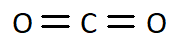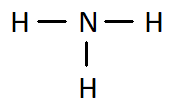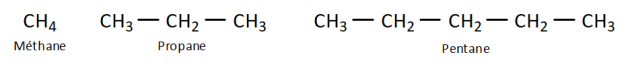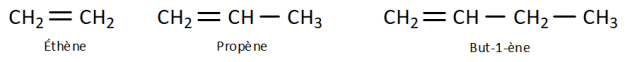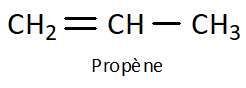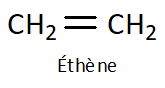🎥 Document vidéo : Première partie⚓
Regarder la vidéo n°1 suivante « C’est pas sorcier : le plastique ça nous emballe… »
1ère partie jusqu’à 7 min, puis répondre aux questions.

Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger la vidéo.
Question⚓
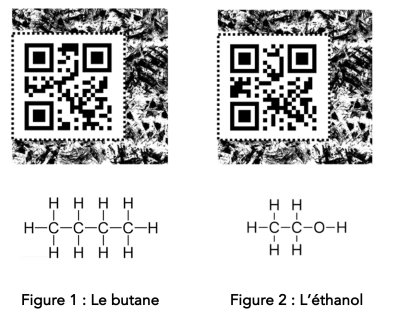
Q2. Comment se nomment les hydrocarbures utilisés pour les fabriquer et combien d’atomes de carbones comportent-ils ? Entre quelles valeurs de température se liquéfie-t-elles ?
Question⚓
Question⚓
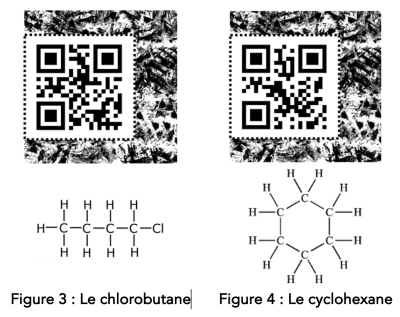
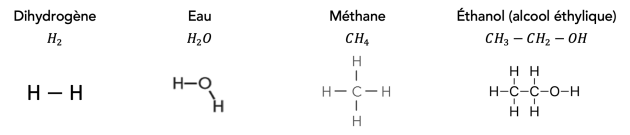
Q4. Ces molécules peuvent être écrites à partir de formules « brutes ». En donner une définition et écrire les formules brutes de ces quatre molécules en dessous de chacune
Question⚓
Question⚓
Q9. Donner toutes les combinaisons possibles de liaisons pour les atomes suivants : \(\ce{C}\), \(\ce{O}\), \(\ce{H}\), \(\ce{C\ell}\) et \(\ce{N}\).
Solution⚓
Q9.
\(\ce{C}\) peut faire :
4 liaisons simples ;
2 liaisons simples + 1 double ;
2 liaisons doubles ;
1 liaison simple + 1 liaison triple.
\(\ce{O}\) peut faire :
2 liaisons simples ;
1 liaison double.
\(\ce{H}\) peut faire :
1 seule liaison simple.
\(\ce{C \ell}\)
1 seule liaison simple.
\(\ce{N}\) peut faire :
3 liaisons simples ;
1 liaison simple + 1 liaison double ;
1 liaison triple.
Question⚓
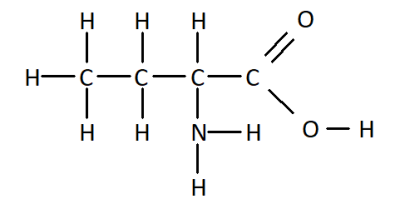
Q10. On a vu qu’il était possible d’écrire une molécule à l’aide d’une formule brute, d’une formule développée, mais également à l’aide d’une formule semi-développée. En donner une définition et écrire des formules de molécules (notamment celle de la question Q7.) à l’aide de la formule semi-développée.
Question⚓
Q12. Comment peut-on aller encore plus loin dans la simplification de l’écriture d’une formule chimique ? Donner des exemples.
Solution⚓
Q12.
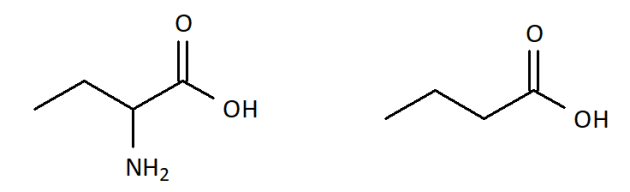
On peut envisager de ne plus représenter les atomes de carbone en plus des atomes d'hydrogène, et de ne laisser que les liaisons entre les atomes de carbone. En revanche, tous les atomes autre que \(\ce{H}\) et \(\ce{C}\) doivent être représenté.
On appelle cette représentation la formule topologique.
Exemples :
✅ Évaluation formative⚓
🤔 Je réfléchis : Alcanes, alcènes⚓
Définition :
Les alcanes sont des hydrocarbures composés uniquement d’atomes de carbone et d’hydrogène reliés par de simples liaisons, ils sont dits « saturés »
.
Définition :
Les alcènes sont une famille d’hydrocarbures dits « insaturés »
, composés uniquement d’atomes de carbone et d’hydrogènes et comportant une double liaison « \(\ce{C=C}\) ».
🤔 Je réfléchis encore : Les polymères (matières plastiques)⚓
Regarder la suite de la vidéo n°1 « C’est pas sorcier : le plastique ça nous emballe… »
, puis répondre aux questions.

Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger la vidéo.
Complément :
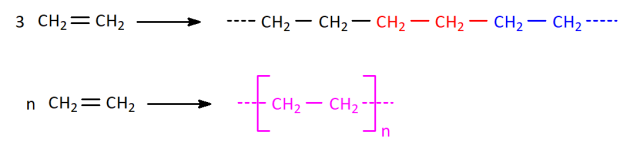
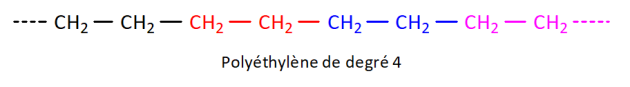
Le polyéthylène, appelé aussi polyéthène (sigle générique PE 
 ) est un polymère utilisé pour fabriquer des bouteilles en plastique.
) est un polymère utilisé pour fabriquer des bouteilles en plastique.
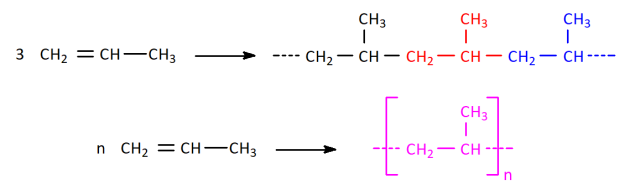
📝Aller plus loin : exemples de polymères⚓
Complément : 📄 Exemples de polymères et de leurs utilisations
Matière plastique | Masse volumique (kg/m3)\(\mathrm{\left( kg/m^{-3} \right)}\) | Exemples |
|---|---|---|
Polyéthylène (PEBD et РЕВН) | 820 – 890 | sacs, films, sachets, bidons, récipients et bouteilles souples tuyaux, jouets, ustensiles ménagers. |
Polypropylène (PP) | 850 – 920 | pare-chocs, tableaux de bord, mobilier de jardin, bouteilles rigides, boîtes alimentaires, fibres de tapis, moquettes, cordes, ficelles... |
Polystyrène (PS) | 1 040 – 1 060 | emballages, jouets, verres plastiques, pots de yaourt, boitiers CD, bacs à douche, isolant thermique. |
Polychlorure de vinyle (PVC) | 1 180 –1 410 | ameublement, pots de margarine, blisters, bouteilles d'eau, tuyaux de canalisation... |
Polytéréphtalate d'éthylène (PET) | 1 380 –1 410 | Fabrication de fils textiles, de films et de bouteilles d'eau et de sodas... |
❇️ Questions bonus : Quelques synthèses supplémentaires⚓
➡️ Synthèse du PVC à partir de l’éthène⚓
L’éthylène (éthène) \(\ce{C2H4}\) réagit avec le dichlore \(\ce{C\ell2}\) pour donner une molécule de chlorure de vinyle après élimination d’une molécule de chlorure d’hydrogène \(HC\ell\).
Question⚓
Q26. Écrire l’équation-bilan de la réaction chimique.
La polymérisation du chlorure de vinyle conduit au polychlorure de vinyle (PVC).
Question⚓
La polymérisation du chlorure de vinyle conduit au polychlorure de vinyle (PVC).
➡️ Synthèse du Téflon®⚓
Le tétrafluorure d’éthylène (TFE) est un dérivé de l’éthène avec remplacement de chaque atome d’hydrogène par un atome de fluor. A température ambiante, ce gaz est inodore, sans saveur et incolore. Par polymérisation, il conduit au Téflon®.
Question⚓
Q28. Écrire la formule développée du tétrafluorure d’éthylène ainsi que l’équation de polymérisation de ce composé.