🚩 Définitions (À SAVOIR)⚓
Définition : Titre Alcalimétrique (T.A.)
Le Titre Alcalimétrique d'une solution (noté T.A.) est égal au volume, exprimé en \(\mathrm{mL}\), d'une solution d'acide chlorhydrique à la concentration molaire \(c=0,020\ \mathrm{mol\ .\ L^{-1}}\) en ions \(H_3O^+\), nécessaire pour titrer un volume \(V=100\ \mathrm{mL}\) de cette solution en présence de phénolphtaléine comme indicateur coloré de fin de réaction.
Le T.A. s'exprime en \(\mathrm{^\circ F}\).
👉 Quand la phénolphtaléine vire du rose à l'incolore, tous les ions carbonate ont été dosés : on est à la première équivalence.
Définition : Titre Alcalimétrique Complet (T.A.C.)
Le titre alcalimétrique complet d'une solution (noté T.A.C.) est égal au volume, exprimé en \(\mathrm{mL}\), de solution d'acide chlorhydrique à la concentration molaire \(c=0,020\ \mathrm{mol\ .\ L^{-1}}\) en ions \(H_3O^+\), nécessaire pour titrer un volume \(V=100\ \mathrm{mL}\)\(\) de cette solution en présence d'hélianthine (ou de vert de bromocrésol) comme indicateur coloré de fin de réaction.
Le T.A.C. s'exprime en \(\mathrm{^\circ F}\).
👉 Quand le vert de bromocrésol vire du bleu au jaune (ou bien quand l'hélianthine vire du jaune au rouge), tous les ions carbonates et hydrogénocarbonates ont été dosés : on est à la seconde équivalence.
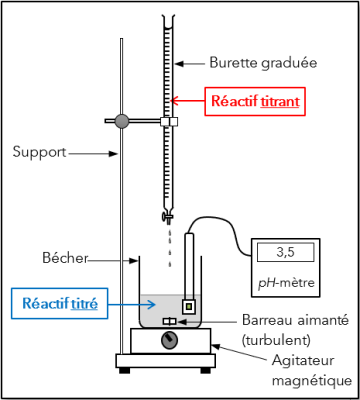
Définition : Le dosage par titrage : vocabulaire et schéma de l'expérience
Un dosage est une technique expérimentale permettant de déterminer la concentration d'une espèce chimique en solution.
Les dosages par titrage mettent en jeu une réaction chimique. Cette réaction doit être totale, rapide et unique. Elle est appelée réaction support du titrage.
La solution de concentration inconnue est appelée solution titrée ou réactif titré.
Lors du dosage par titrage, le réactif titré va réagir avec une solution de concentration connue appelée solution titrante ou réactif titrant.
📝 Étude préliminaire⚓
Complément : Document n°1 : Composition d'une eau, et alcalinité d'une eau

Lorsque les eaux de ruissellement s'infiltrent dans le sol, elles se purifient par filtration naturelle des matières en suspension qu'elles peuvent transporter et elles s'enrichissent simultanément en sels minéraux par dissolution de certaines des espèces chimiques contenues dans les roches traversées. Elles peuvent aussi entraîner des substances liées à l'activité humaine (ions nitrates, pesticides...).
Selon la nature du terrain dans lequel elles se sont lentement infiltrées, les eaux naturelles ont des compositions très différentes. Les ions les plus couramment rencontrés sont les ions sodium \(\left(Na^+\right)\), potassium \(\left(K^+\right)\), magnésium \(\left({Mg}^{2+}\right)\), calcium \(\left({Ca}^{2+}\right)\), chlorure \(\left({C\ell}^-\right)\), sulfate \(\left({SO}_4^{2-}\right)\) et hydrogénocarbonate[*] (*) \(\left(HCO_3^-\right)\).
L'alcalinité d'une eau, qu'elle soit une eau de ruissellement, l'eau du robinet, une eau minérale, ou une eau d'un circuit de refroidissement, correspond à la présence d'espèces basiques telles que les ions hydroxyde \(HO^-\), les ions carbonate \(CO_3^{2-}\), les ions hydrogénocarbonate \(HCO_3^-\) et, dans une moindre mesure, les ions phosphate \(PO_4^{3-}\), silicates \(SiO_3^{2-}\), ...
(*) il est aussi nommé « ion bicarbonate ».
Attention : ✋
Dans ce qui suit, nous ne prendrons en compte que les ions hydroxyde, les ions carbonate et les ions hydrogénocarbonate (cas le plus fréquemment rencontré).
Complément : Document n°2 : Quelques pKa à 25 °C
La dissolution du dioxyde de carbone \(CO_2\) dans l'eau de pluie, dans l'eau du robinet ou dans les eaux d'installations conduit à la formation de l'ion hydrogénocarbonate \(HCO_3^-\) et de l'ion carbonate \(CO_3^{2-}\).
Les couples acido-basiques mis en jeux sont donnés ci-contre :

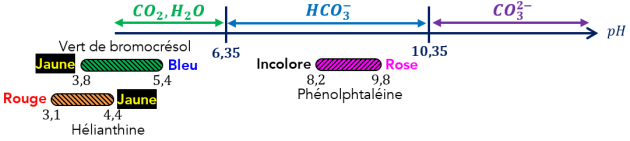
Complément : Document n°3 : Zones de virage des indicateurs colorés
Question⚓
Q3. (RÉA) Écrire les équations des réactions de chacun des deux acides considérés dans le Doc.2 avec l'eau.
Question⚓
Q4. (RÉA) Pourquoi dit-on que l'ion hydrogénocarbonate est une espèce amphotère ?
Solution⚓
A1-Q4.
L'ion hydrogénocarbonate est la base du couple \(CO_2,H_2O_{ \left(aq\right)}\ / \ HCO_{3\ \left(aq\right)}^-\) et est aussi l'acide du couple \(HCO_{3\ \left(aq\right)}^-\ / \ CO_{3\ \left(aq\right)}^{2-}\). Les ions hydrogénocarbonate ont donc des propriétés acides et basiques (dans deux couples différents) : ce sont des ampholytes (on dit qu'il s'agit d'une espèce amphotère).
Complément : Remarque
Le dosage (en présence de phénolphtaléine) permet d'accéder à la concentration en ions carbonate et en ions hydroxyde de l'eau). Le second dosage (en présence d'hélianthine ou en présence de vert de bromocrésol) nous permet d'accéder à la concentration totale en ces trois ions !
Définition : On retiendra donc :
Le dosage en présence de phénolphtaléine d'une telle eau permet d'accéder au T.A.
Le dosage en présence d'hélianthine d'une telle eau permet d'accéder au T.A.C.
Question⚓
Q6. (ANA) [Doc.3] Si on ajoute quelques gouttes de phénolphtaléine dans une solution où les ions carbonate sont prédominants, quelle est la couleur prise par la solution ? Justifier la réponse.
Question⚓
Q7. (ANA) Doc.3] Si on ajoute quelques gouttes de phénolphtaléine dans une solution où les ions hydrogénocarbonates sont prédominants, quelle est la couleur prise par la solution ? Justifier la réponse.
🧪 Expériences : Dosages⚓
Complément : Principe du dosage
Il s'agit de réaliser un dosage colorimétrique afin de déterminer l'alcalinité d'une eau c'est-à-dire sa capacité à réagir avec les ions oxonium \(\left(H_3O^+\right)\).
Protocole expérimental n°1
Dosage colorimétrique : Prise d'essai
1. Après avoir rincé la fiole jaugée avec de l'eau minérale EVIAN®, utiliser celle-ci pour verser, dans un bécher de \(150\ mL\), un volume \(V_0=25\ mL\) de cette eau minérale.
2. Rajouter un turbulent (barreau aimanté) et environ 10 gouttes de phénolphtaléine. Observer la coloration prise par la solution.
3. Si la solution n'est pas colorée, rajouter environ 10 gouttes de vert de bromocrésol dans le bécher.
4. Remplir la burette avec la solution d'acide chlorhydrique \(\left(c=0,020\ mol.L^{-1}\right)\) et faire le zéro.
5. Placer le bécher sur un agitateur magnétique et le tout sous la burette graduée (voir dessin ci-dessus).
6. Verser rapidement l'acide chlorhydrique mL par mL jusqu'à ce que l'indicateur coloré commence à changer de couleur. À ce moment-là, ralentir l'écoulement pour atteindre la teinte sensible du vert de bromocrésol : le changement de couleur doit être persistant et se faire à la goutte près.
7. Noter le volume d'acide versé lorsque l'indicateur coloré (BCR) a changé de couleur : on est à l'équivalence.
Schéma
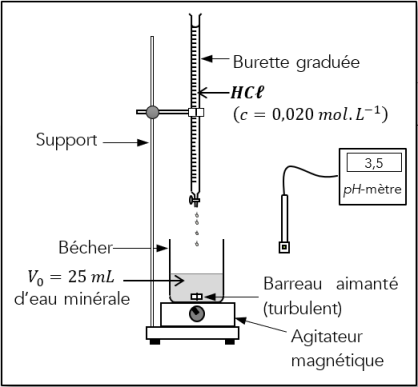
Protocole expérimental n°2
Titrage pH-métrique : Titrage précis
❶ Reproduire les étapes de 2. à 5. du dosage colorimétrique précédent.
❷ Étalonner le pH-mètre en suivant les consignes du professeur.
Cet étalonnage ne sera fait qu'une seule fois sauf si la console est éteinte ou si l'électrode pH est débranchée
❽ Plonger la sonde (électrode de verre) du pH-mètre dans l'eau et mesurez son pH initial. Notez cette valeur dans le tableau ci-dessous.
❾ Verser, millilitre par millilitre, la solution d'acide chlorhydrique en agitant et en notant dans le tableau la valeur du pH de la solution après chaque ajout (réduire l'agitation avant de noter la valeur du pH).
![]() L'électrode du pH-mètre doit être immergée mais ne doit pas être heurtée par le barreau aimanté.
L'électrode du pH-mètre doit être immergée mais ne doit pas être heurtée par le barreau aimanté.
![]() Diminuer le volume à 2 mL d'acide chlorhydrique versé autour du volume équivalent déterminé lors de la prise d'essai.
Diminuer le volume à 2 mL d'acide chlorhydrique versé autour du volume équivalent déterminé lors de la prise d'essai.
Complément : Remarque :
Le relevé des valeurs du pH de la solution en fonction du volume versé d'acide fort, peut se faire à l'aide d'un système d'acquisition (console FOXY + Ordinateur).
Suivre, dans ce cas, les consignes de la fiche méthode mise à votre disposition (et du professeur) et pour le paramétrage et l'utilisation du système d'acquisition.
Tableau des mesures : dans le cas où le relevé du pH ne peut pas se faire à l'aide d'un système d'acquisition
\(V_A\ \mathrm{\left(mL\right)}\) |
|
|
|
|
|
|
|
|
|
|
|---|---|---|---|---|---|---|---|---|---|---|
\(pH\) |
\(V_A\ \mathrm{\left(mL\right)}\) |
|
|
|
|
|
|
|
|
|
|
|---|---|---|---|---|---|---|---|---|---|---|
\(pH\) |
\(V_A\ \mathrm{\left(mL\right)}\) |
|
|
|
|
|
|
|
|
|
|
|---|---|---|---|---|---|---|---|---|---|---|
\(pH\) |
Si le système d'acquisition ne le permet pas, représenter, à l'aide d'un tableur-grapheur (comme Regressi), la courbe \(pH=f\left(V_A\right)\).
📐 Exploitation des résultats expérimentaux⚓
La teneur en ions hydrogénocarbonate, encore appelés parfois bicarbonate, des eaux minérales est variable mais ces ions sont toujours présents. Ce sont les principaux responsables de l'alcalinité des eaux d'alimentation.
L'alcalinité d'une eau correspond à sa capacité à réagir avec les ions oxonium \(\left(H_3O^+\right)\). Par exemple, les lacs dont l'eau a une grande alcalinité seront moins sensibles aux pluies acides. On la détermine en dosant l'eau par un acide fort. Le résultat s'exprime à l'aide du TA (Titre Alcalimétrique) et du TAC (Titre Alcalimétrique Complet).
Donnée : \(M\left(HCO_3^-\right)=61\ \mathrm{g.mol^{-1}}\)
Question⚓
Q9. (APP) À l'aide de l'étude préliminaire et du Doc.3, justifier le choix du vert de bromocrésol (BCR) comme indicateur coloré de fin de réaction.
Définition : Notion d'équivalence (à savoir)
Le volume à l'équivalence ou volume équivalent est le volume de solution titrante qu'il faut ajouter à la solution titrée pour que les deux réactifs soient dans les proportions stœchiométriques de la réaction du titrage. Les deux réactifs sont alors totalement consommés.
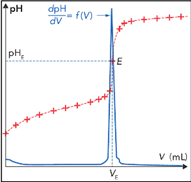
Complément : Document n°4 : Comment déterminer graphiquement une équivalence du dosage ?
Il existe deux techniques pour déterminer l'équivalence du dosage :
Méthode de la courbe dérivée : La courbe \(pH=f\left(V\right)\) est superposée à sa courbe dérivée \(\dfrac{dpH}{dV}=f\left(V\right)\). Le volume à l'équivalence est l'abscisse du maximum de la courbe dérivée. Cette méthode nécessite un logiciel de traitement de données.
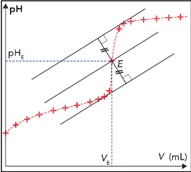
Méthode des tangentes parallèles :
Tracer deux tangentes à la courbe \(pH=f\left(V\right)\), parallèles entre elles et situées avant et après le saut de pH.
Tracer ensuite la parallèle à ces deux tangentes, équidistante de celles-ci. Son intersection avec la courbe \(pH=f\left(V\right)\) détermine les coordonnées du point d'équivalence.
Cette méthode nécessite d'imprimer ou de tracer la courbe.
Question⚓
Q15. (RCO) De quel type d'espèce chimique sont alors ces ions ? Rappeler alors la définition de ce type d'espèce chimique selon Brönsted.
Question⚓
Q16. (RÉA) En déduire la relation liant les quantités de matières des réactifs à l'équivalence.
Question⚓
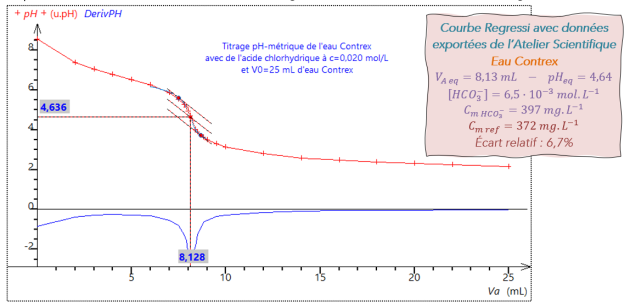
Q17. (RÉA) Calculer la concentration molaire puis massique des ions hydrogénocarbonate \(\left(HCO_3^-\right)\) dans l'eau analysée. Écrire la valeur avec 3 CS.
Solution⚓
A1-Q17.
De la relation précédente on en déduit :
Concentration molaire : \(\Big[HCO_3^-\Big]=\dfrac{c\times V_{A,eq}}{V_0}\)
Concentration en en masse : \(C_{m\ HCO_3^-}=\Big[HCO_3^-\Big]\times M\left(HCO_3^-\right) \\ C_{m\ HCO_3^-}=\dfrac{c\times V_{A,eq}}{V_0}\times M\left(HCO_3^-\right)\)
Applications numériques : \(\Big[HCO_3^-\Big]=\dfrac{0,020\times7,0\cdot{10}^{-3}}{25,0\cdot{10}^{-3}}\hspace{20mm} C_{m\ HCO_3^-}=\dfrac{0,020\times7,0\cdot{10}^{-3}}{25,0\cdot{10}^{-3}}\times61 \\ \Big[HCO_3^-\Big]=5,60\cdot{10}^{-3}\ \mathrm{mol.L^{-1}} \hspace{20mm} C_{m\ HCO_3^-}=3,42\cdot{10}^{-1}\ \mathrm{g.L^{-1}}=342\ \mathrm{mg.L^{-1}}\)
Question⚓
Q18. (RÉA/VAL) Calculer l'écart relatif par rapport à la valeur indiqué par le fabriquant. Conclure.
\(\textrm{écart relatif : }\ \ \ r=\dfrac{\Big|\ \textrm{Valeur de référence}-\textrm{Valeur expérimentale}\ \Big|}{\textrm{Valeur de référence}}\)
Solution⚓
A1-Q18.
\(r=\dfrac{\Big|\ C_{m\ fabriquant}-C_{m\ HCO_3^-}\ \Big|}{C_{m\ fabriquant}}=\dfrac{\Big|\ 360-342\ \Big|}{360}=0,05=5\ \%\)
L'étiquette de la bouteille d'eau minérale indique une concentration massique en ion hydrogénocarbonate de \(360\ \mathrm{mg.L^{-1}}\). Soit un écart relatif de \(5\ \%\). L'information annoncée par le fabricant correspond bien à la valeur déterminée expérimentalement.
Question⚓
Q20. (ANA/RÉA) Déterminer le T.A.C. de l'eau analysée.
Solution⚓
A1-Q20.
D'après la définition du T.A.C., il faut utiliser une solution d'acide chlorhydrique à \(c=0,020\ \mathrm{mol.L^{-1}}\) pour doser \(100\ \mathrm{mL}\) d'eau. On a utilisé seulement \(25\ \mathrm{mL}\) d'eau, donc le T.A.C. est donné par \(4\times V_{A,eq}\).
Soit : \(\mathrm{T.A.C.} =28\ \mathrm{^\circ F} \ \ \ \left(V_{A,eq}=7\ \mathrm{mL}\right)\)
Question⚓
Q21. (RÉA/VAL) Calculer l'écart relatif entre la valeur théorique et la valeur expérimentale du T.A.C. Conclure.
Donnée : \(\mathbf{1^\circ F=12,2\ mg/L}\) d'ion hydrogénocarbonate \(HCO_3^-\).
Solution⚓
A1-Q21.
La valeur théorique du T.A.C. est : \(\dfrac{360}{12,2}=29,5\ \mathrm{^\circ F}\). La valeur expérimentale vaut : \(28\ \mathrm{^\circ F}\).
\(r=\dfrac{\left| \ 29,5-28\ \right| }{29,5}=0,05=5 \ \%\)
L'écart relatif vaut 5 %, le résultat obtenu par titrage pH-métrique montre une différence de 5% par rapport à la valeur annoncée par le fabriquant. L'information sur l'étiquette semble donc correcte.