🔖 Définitions⚓
🔖 Qu’est-ce qu’une combustion ?⚓
📌 Définition à savoir
📌 Le triangle du feu
🔥 Les différents types de combustibles⚓
📌 Définition à savoir
📌 Définition à savoir
Question⚓
Q15. Pourquoi l’uranium et les autres corps radioactifs ne sont pas des combustibles au sens précis du terme pour les combustions ?
Solution⚓
Q15.
L'uranium et les autres corps radioactifs, qui produisent de l'énergie par fission nucléaire, ne sont pas des combustibles au sens précis du terme car, lors de leur utilisation, ils ne participent à aucune réaction de combustion. Ils participent à ce qu’on appelle des réactions nucléaires ne faisant intervenir que le noyau des éléments, pas leurs électrons.
🔥 Combustions complètes et incomplètes⚓
Complément : Document n°1 : La combustion du butane
On utilise un briquet pour observer la combustion du butane. Après amorçage grâce à des étincelles, le butane brûle à la sortie d'un briquet au contact du dioxygène.
Cette combustion est réalisée dans des conditions différentes :
avec un faible débit de butane (le butane est libéré lentement par le briquet).
avec un fort débit de butane (le butane est libéré rapidement).
Expérience 1 : faible débit de butane

Expérience 2 : fort débit de butane

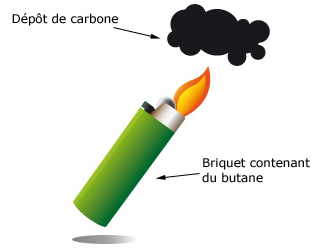
En plaçant une coupelle blanche au-dessus de la flamme il se forme un dépôt noir constitué de carbone.
Question⚓
Q20. Quelles doivent être les conditions pour avoir une combustion incomplète ?
🥼 Les réactions de combustions et les équations chimiques⚓
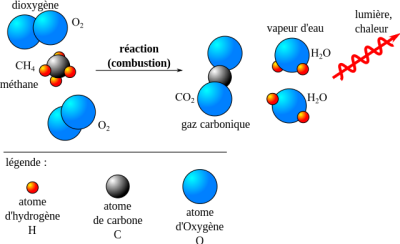
⚛️ La réaction de combustion du méthane⚓
Complément : Document n°2 : La combustion du méthane
La combustion complète d’un hydrocarbure (exemple le méthane) avec le dioxygène de l’air, conduit à la formation de dioxygène de carbone et d’eau.
Exemple :
Les chaudières à condensation à gaz utilisant comme combustible le méthane. (L’aspect « condensation » sera étudié dans une autre activité).
Équation de réaction de la combustion complète du méthane :
\(\ce{CH_{4\ (g)} + 2\ O_{2\ (g)} -> CO_{2\ (g)} + 2\ H_2O_{(g)}}\)
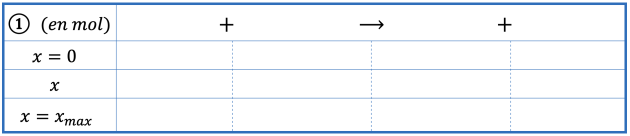
Lors d’une combustion, les quantités de matières initiales (en mole) doivent être dans les proportions stœchiométriques de l’équation de la réaction.
Les quantités de matières des réactifs diminuent, tandis que celles des produits augmentent. Pour cela, on utilise un tableau d’avancement.
Question⚓
Solution⚓
Q24.
Lors de la combustion complète de \(0,1\ \mathrm{mol}\) méthane, la quantité de matière en dioxygène consommée sera 2 fois plus importante que celle en méthane car une molécule de méthane réagit avec deux molécules de dioxygène.
Donc \(\left(n_{\ce{O2}}\right)_i=0,2\ \mathrm{mol}\).
Détermination de \(x_\text{max}\) :
Si \(\ce{CH4}\) est le réactif limitant :
\(0,1-x_\text{max}=0 \ \ \Leftrightarrow \ \ x_\text{max}=0,1\ \mathrm{mol}\)
Si \(\ce{O2}\) est le réactif limitant :
\(0,2-2\ x_\text{max}=0\ \ \Leftrightarrow \ \ x_\text{max}=0,1\ \mathrm{mol}\)
L’avancement maximal est la plus petite des valeurs calculées précédemment, on a donc \(x_\text{max}=0,1\ \mathrm{mol}\).
On est dans le cas où tous les réactifs ont totalement réagi. Il n’y a pas de réactif limitant. Les réactifs ont été mis dans les proportions stœchiométriques.
Dans ce cas précis de combustion dans l’air, le dioxygène est considéré en excès car il y en a une quantité quasi infinie. On peut alors considérer que le réactif limitant est le méthane.
Il se forme donc \(\left(n_{\ce{CO2}}\right)_f=0,1\ \mathrm{mol}\) et \(\left(n_{\ce{H2O}}\right)_f=0,2\ \mathrm{mol}\).
💪 Petit exercice⚓
Le biodiesel ou carburant diester est un biocarburant issu des graines de plantes pouvant produire de l'huile, telles que le colza ou encore le tournesol. L'EMC (éther méthylique de colza) est l'un de ces biocarburants. Sa formule brute est \(\ce{C19H34O2}\).
Question⚓
Q25. Écrire l'équation de combustion complète de l'EMC avec le dioxygène.
Le kérosène est un carburant constitué des molécules suivantes :\(\ce{C10H22}\), \(\ce{C11H24}\), \(\ce{C12H26}\), \(\ce{C13H28}\), \(\ce{C14H30}\).
Question⚓
Q27. Écrire les équations de réaction de combustion de ces différentes molécules.
Question⚓
Q28. Écrire l’équation de réaction de combustion du 2,3-diméthylpentan-1,2,3-triol de formule brute : \(\ce{C5H16O3}\).
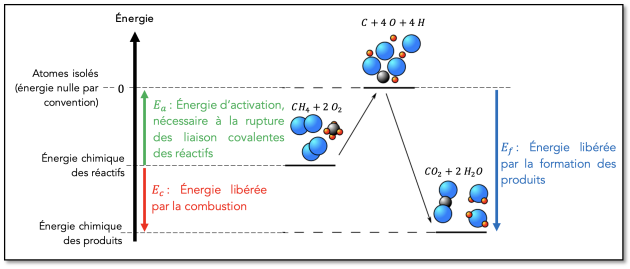
⚡️ Aspect énergétique⚓
⚡️ Énergie libérée mors d’une combustion⚓
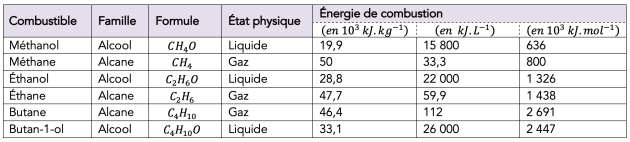
⚡️ Énergie de combustion⚓
📌 Définition à savoir
Complément : 👉🏻 Remarques
Nous étudierons le pouvoir calorifique inférieur PCI et le pouvoir calorifique supérieur PCS dans une autre activité.
Les valeurs étant relativement importantes, on utilise souvent le \(\mathrm{kJ\cdot mol^{-1}}\).
Il est parfois plus intéressant pour comparer les combustibles de prendre comme référence la masse plutôt que la quantité de matière, on utilise le pouvoir calorifique.
Pour le quotidien, il est utile de connaitre les valeurs d'énergies de combustion en \(\mathrm{J\cdot L^{-1}}\) puisque les réservoirs des cuves sont donnés en litre.
Il n'est cependant pas possible de comparer ces énergies entre gaz et liquides.
♨️ Chauffage d'un corps⚓
Rappel : 📌 Définition à savoir
Lors d’une variation de température \(\Delta\theta\) d’un corps de masse \(m\), l’énergie \(Q\) du transfert thermique s’exprime par :
La valeur du transfert thermique est positive si le corps reçoit de la chaleur et négative s’il en donne.
L’énergie nécessaire au changement d’état d’un corps de masse \(m\) est :