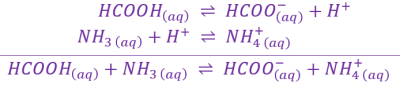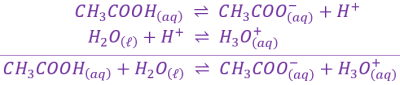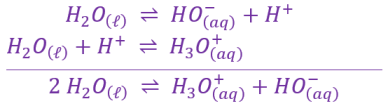👨🎓 Les couples acide-bases⚓
Complément : Document n°1 : La théorie de Brönsted-Lowry
En 1923, les chimistes J.N. Brönsted et T.M. Lowry ont défini et publié à quelques mois d'intervalles et de manière indépendante une étude sur les notions d'acide, de base et de couple acide-base.
Ces définitions permettent de comprendre les réactions mettant en jeu un acide et une base appelées réactions acido-basiques :
Un acide est une entité chimique susceptible de céder un ion \(\large \mathbf{H^+}\) (on parle aussi de proton \(H^+\)).
Une base est une entité chimique susceptible d'accepter un ion \(\large \mathbf{H^+}\) (on parle aussi de proton \(H^+\)).
Deux entités chimiques forment un couple acide-base s'il est possible de transformer l'une en l'autre par perte ou gain d'un seul ion hydrogène. Les deux entités du couple sont dites conjuguées.
Une réaction acido-basique résulte d'un transfert d'un ion \(\large \mathbf{H^+}\) d'un acide vers une base.

Complément : Document n°2 : Les réactions acido-basiques
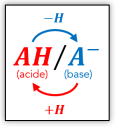
Le couple acide-base
Soit un acide \(\large \mathbf{AH}\) et sa base conjuguée \(\large \mathbf{A^-}\). Ces deux entités forment un couple acide-base noté \(\large \mathbf{AH\, /\, A^-}\).
Les deux entités d'un couple acide-base sont reliées par la demi-équation suivante :
\[\large \mathbf{ A {\textcolor{red}H}\ \rightleftharpoons \ A^- + {\textcolor{red}{H^+}} }\]
La réaction acido-basique
Lors d'une réaction acido-basique, deux couples acides-bases interviennent en s'échangeant un ion \(\large \mathbf{H^+}\).
Soit les couples \(\large \mathrm{AH\, /\, A^-}\) et \(\large \mathrm{BH\, /\, B^-}\), l'équation bilan modélisant la réaction acido-basique entre l'acide \(\large \mathrm{AH}\) du premier couple et la base \(\large \mathrm{B^-}\) du deuxième couple s'écrit en additionnant les deux demi-équations reliant les couples :
\[\begin{array}{rcl} \large{\mathrm{ A {\textcolor{red}H} } } & \large{\rightleftharpoons} & \mathrm{\large A^- + {\textcolor{red}{H^+}}} \\ \large{\mathrm{B^- + {\textcolor{red}{H^+}}} } & \large{\rightleftharpoons} & \mathrm{\large B {\textcolor{red}H} } \\ \end{array} \\ \text{ -------------------------------------------- } \\ \begin{array}{rcl} \mathrm{\large A {\textcolor{red}H} + B^- } & \large{\rightleftharpoons} & \mathrm{\large A^- + B {\textcolor{red}H}} \end{array}\]
⚠ Attention : L'équation associée à une réaction acido-basique ne fait pas apparaître d'ions \(\large \mathrm{H^+}\).
La double flèche \(\rightleftharpoons\) indique que la réaction peut avoir lieu dans les deux sens.
Complément : Document n°3 : Quelques couples acide-base
\(\large\mathrm{H_3O_{\left(aq\right)}^+\, / \, H_2O_{\left(\ell\right)}}\)
\(\large\mathrm{HCOOH_{\left(aq\right)} \, / \, HCOO_{\left(aq\right)}^-}\)
\(\large\mathrm{CH_3COOH_{\left(aq\right)} \, / \, CH_3COO_{\left(aq\right)}^-}\)
\(\large\mathrm{ HC\ell O_{\left(aq\right)} \, / \, C\ell O_{\left(aq\right)}^- }\)
\(\large\mathrm{NH_{4\ \left(aq\right)}^+ \, / \, NH_{3\ \left(aq\right)} }\)
\(\large\mathrm{H_2O_{\left(\ell\right)} \, / \, HO_{\left(aq\right)}^- }\)
Quelques noms d'espèces chimiques :
\(\large\mathrm{H_3O_{\left(aq\right)}^+}\) : ion oxonium
\(\large\mathrm{HO_{\left(aq\right)}^-}\) : ion hydroxyde
\(\large\mathrm{NH_{3\ \left(aq\right)}}\) : ammoniac
\(\large\mathrm{NH_{4\ \left(aq\right)}^+}\) : ion ammonium
\(\large\mathrm{HCOO_{\left(aq\right)}^-}\) : ion méthanoate
\(\large\mathrm{CH_3COO_{\left(aq\right)}^-}\) : ion éthanoate
Lors d'une réaction acido-basique, les deux espèces chimiques suivantes réagissent : \(\large\mathrm{CH_3COOH_{\left(aq\right)}}\) et \(\large\mathrm{NH_{3\ \left(aq\right)}}\).
Question⚓
Q3. Écrire les deux demi-équations acido-basiques mises en jeu et en déduire l'équation de cette réaction acido-basique.
Solution⚓
A1-Q3.
\[\begin{array}{rcl} \hspace{17mm} \large{\mathrm{ CH_3COOH_{\left(aq\right)}\ } } & \large{\rightleftharpoons} & \large\mathrm{ CH_3COO_{\left(aq\right)}^-+H^+ } \\ \hspace{17mm} \large{\mathrm{NH_{3\ \left(aq\right)}+H^+}} & \large{\rightleftharpoons} & \mathrm{\large NH_{4\ \left(aq\right)}^+ } \\ \end{array} \\ \text{ -------------------------------------------------------------------------------------- } \\ \begin{array}{rcl} \mathrm{\large CH_3COOH_{\left(aq\right)}+NH_{3\ \left(aq\right)} } & \large{\rightleftharpoons} & \mathrm{\large CH_3COO_{\left(aq\right)}^-+NH_{4\ \left(aq\right)}^+} \end{array}\]
Question⚓
Q4. D'après le Doc.3, que remarque-t-on de particulier concernant l'eau ?
Solution⚓
A1-Q4.
L'eau fait partie de deux couples acide-base et est soit l'espèce basique, soit l'espèce acide.
Dans le couple \(\mathrm{H_3O_{\left(aq\right)}^+\, / \, H_2O_{\left(\ell\right)}}\) elle est l'espèce basique ; dans le couple \(\mathrm{H_2O_{\left(\ell\right)} \, / \, HO_{\left(aq\right)}^- }\) elle est l'espèce acide.
💪 Exercice n°1 :⚓
Question⚓
Q5. Après avoir identifié l'espèce acide et l'espèce basique, écrire les demi-équations et en déduire l'équation des réactions acido-basiques entre les acides et bases suivants :
a. Réaction entre \(\mathrm{HCOOH_{\left(aq\right)}}\) et l'ammoniac \(\mathrm{NH_{3\ \left(aq\right)}}\).
b. Réaction entre \(\mathrm{CH_3COOH_{\left(aq\right)}}\) et l'eau \(\mathrm{H_2O_{\left(\ell\right)}}\).
c. Réaction entre l'ammoniac \(\mathrm{NH_{3\ \left(aq\right)}}\) et l'eau \(\mathrm{H_2O_{\left(\ell\right)}}\).
Solution⚓
A1-Q5.
a. Réaction entre \(\mathrm{HCOOH_{\left(aq\right)}}\) et l'ammoniac \(\mathrm{NH_{3\ \left(aq\right)}}\).
L'espèce acide est : \(HCOOH_{\left(aq\right)}\) ; et la base est : \(NH_{3\ \left(aq\right)}\).
c. Réaction entre l'ammoniac \(\mathrm{NH_{3\ \left(aq\right)}}\) et l'eau \(\mathrm{H_2O_{\left(\ell\right)}}\).
L'espèce acide est : \(H_2O_{\left(\ell\right)}\) ; et la base est : \(NH_{3\ \left(aq\right)}\).
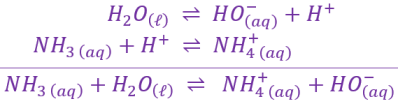
💪 Exercice n°2 :⚓
Question⚓
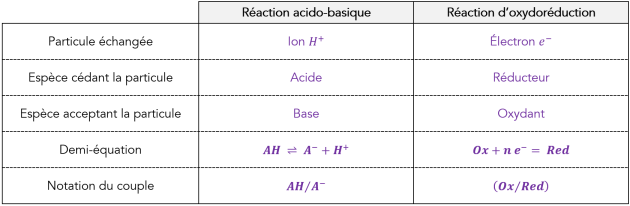
Q6. Quelle sont les deux différences dans cette analogie ?
👨🎓 Le cas particulier de l'eau⚓
Définition : Document n°4 : L'eau, ampholyte
L'eau appartient à deux couples acido-basiques différents : \(\mathrm{H_3O_{\left(aq\right)}^+\, / \, H_2O_{\left(\ell\right)}}\) \(\mathrm{H_2O_{\left(\ell\right)} \, / \, HO_{\left(aq\right)}^- }\)
Elle peut ainsi jouer le rôle d'un acide ou d'une base en fonction des situations. On dit alors que l'eau est un ampholyte[*] ou une espèce amphotère[*].
Complément : Document n°5 : L'autoprotolyse de l'eau
La réaction entre les formes acide \(H_2O_{\left(\ell\right)}\) et basique \(H_2O_{\left(\ell\right)}\) de l'eau est appelée autoprotolyse de l'eau.
L'autoprotolyse de l'eau est une réaction très limitée mais a lieu dans toutes les solutions aqueuses.
Elle est modélisée par l'équation suivante : \(\large \mathrm{ 2\ H_2O_{\left(\ell\right)} \ \rightleftharpoons \ H_3O_{\left(aq\right)}^+\ +\ HO_{\left(aq\right)}^- }\)
Ainsi, toute solution aqueuse contient des ions oxonium \(H_3O_{\left(aq\right)}^+\) et des ions hydroxyde \(HO_{\left(aq\right)}^-\).
Les concentrations \(\Big[H_3O^+\Big]\) et \(\Big[HO^-\Big]\) sont reliées par une constante \(\mathbf{K_\mathrm{e}}\), appelée produit ionique de l'eau.
\(\mathrm{K_\mathrm{e}}\) est sans unité.
À \(25\ \mathrm{^\circ C}\), elle est définie par : \[\fbox{$ \begin{array}{rcl} \large{\color{black} \mathbf{ K_e=\Big[H_3O^+\Big]\ \times\ \Big[HO^-\Big]=1,0\cdot{10}^{-14} } } \end{array} $} \]
Parfois, on utilise le \(\mathrm{pK_e}\) défini par : \[\fbox{$ \begin{array}{rcl} \large{\color{black} \mathbf{ pK_e=-\log{ K_e} } } \end{array} $} \]
Question⚓
Q7. Écrire la demi-équation acido-basique dans laquelle l'eau joue le rôle d'un acide :
Q8. Écrire la demi-équation acido-basique dans laquelle l'eau joue le rôle d'une base
💪 Exercice n°3 :⚓
Définition : Quantité de matière et masse molaire atomique
La quantité de matière d'une espèce chimique représente le nombre de moles contenues dans un échantillon de cette espèce.
Par convention, elle est notée avec la lettre \(n\) et s'exprime en mole, de symbole \(\mathbf{mol}\).
Une mole d'entités est un « paquet » contenant \(6,02\cdot{10}^{23}\) entités.
La masse molaire atomique \(M\) est la masse d'une mole de cet atome. Elle est notée \(M\) et s'exprime en \(\mathrm{g.mol^{-1}}\).
Quelques valeurs de masse molaires atomiques :
\(M_H=1,0\ \mathrm{g.mol^{-1}}\) \(M_C=12,0\ \mathrm{g.mol^{-1}}\) \(M_O=16,0\ \mathrm{g.mol^{-1}}\)
Question⚓
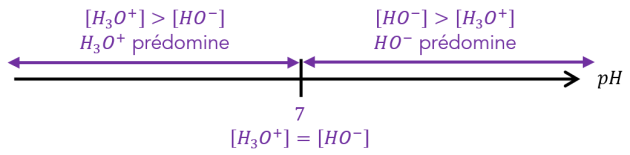
Q10. À \(25 \mathrm{\ ^\circ C}\), calculer la concentration des ions oxonium \(\Big[H_3O^+\Big]\) et hydroxyde \(\Big[HO^-\Big]\) d'une solution neutre. Comparer ces deux valeurs et commenter ce résultat.
Solution⚓
A2-Q10.
Une solution neutre a un \(\mathrm{pH=7}\). Donc \(\Big[H_3O^+\Big]={10}^{-pH}={10}^{-7}\ \mathrm{mol.L^{-1}}\).
\(K_e=\Big[H_3O^+\Big]\ \times\ \Big[HO^-\Big]\ \ \Longleftrightarrow\ \ \Big[HO^-\Big]=\dfrac{K_e}{\Big[H_3O^+\Big]}=\dfrac{{10}^{-14}}{{10}^{-7}}={10}^{-7}\ mol.L^{-1}\)
On constate que pour une solution neutre, on a \(\mathbf{\Big[HO^-\Big]=\Big[H_3O^+\Big]}={10}^{-7}\ \mathrm{mol.L^{-1}}\).
Il y a autant d'ions hydroxyde que d'ions oxonium dans une solution neutre. (À retenir !)
Question⚓
Q11. À \(25 \mathrm{\ ^\circ C}\), calculer la concentration des ions oxonium \(\Big[H_3O^+\Big]\) et hydroxyde \(\Big[HO^-\Big]\) d'une solution basique de \(pH=9,38\). Comparer ces deux valeurs et commenter ce résultat.
Solution⚓
A2-Q11.
\(\Big[H_3O^+\Big]={10}^{-pH}={10}^{-9,38}\ \mathrm{mol.L^{-1}}=4,17\cdot {10}^{-10}\ \mathrm{mol.L^{-1}}\).
\(K_e=\Big[H_3O^+\Big]\ \times\ \Big[HO^-\Big]\ \ \Longleftrightarrow\ \ \Big[HO^-\Big]=\dfrac{K_e}{\Big[H_3O^+\Big]}\)
On a donc : \(\Big[HO^-\Big]=\dfrac{ {10}^{-14} }{ {10}^{-9,38} }={10}^{-4,32}\ \mathrm{mol.L^{-1}}=2,40\cdot {10}^{-5}\ \mathrm{mol.L^{-1}}\)
On constate que pour une solution basique, on a \(\mathbf{\Big[HO^-\Big]>\Big[H_3O^+\Big]}\).
Il y a davantage d'ions hydroxyde que d'ions oxonium dans une solution basique : on dit que les ions \(\mathbf{HO^- }\) sont majoritaires. (À retenir !)
Question⚓
💪 Exercice n°4 :⚓
Pour préparer une solution aqueuse de soude, une masse \(m=4,0\ \mathrm{mg}\) d'hydroxyde de sodium \(NaOH_{\left(s\right)}\) est dissoute dans un volume d'eau \(V=100\ \mathrm{mL}\).
Question⚓
Q13. Écrire l'équation de dissolution de l'hydroxyde de sodium dans l'eau. En déduire la concentration des ions hydroxyde \(HO_{\left(aq\right)}^-\), des ions oxonium \(H_3O_{\left(aq\right)}^+\) et le pH de la solution. Comparer ces deux valeurs et commenter ce résultat.
Solution⚓
A2-Q13.
\(NaOH_{\left(s\right)} \ \overset{eau}{\longrightarrow}\ Na_{\left(aq\right)}^++\ HO_{\left(aq\right)}^-\)
La quantité de matière en hydroxyde de sodium solide (soude) introduite est \(n_\mathrm{soude}\). Lors de la dissolution il se formera \(n_{HO^-}=n_\mathrm{soude}\) (les coefficients stœchiométriques sont identiques).