Complément : 🖥️ Vidéo : C'est pas sorcier - BETON : Les sorciers au pied du mur
Regarder la vidéo suivante et répondre aux questions des différentes parties

( lien : https://dgxy.link/DyTlK )
📄 Généralités⚓
Question⚓
Dans le langage courant le ciment et le béton sont souvent confondus.
Q7. Quelle est la différence entre le béton et le ciment ?
Solution⚓
Q7.
Le béton est un matériau de construction qui est fabriqué à partir d’un mélange de plusieurs constituants : l’eau, le sable, les graviers et bien sûr le ciment.
Le ciment est donc l’un des constituant du béton.
Le ciment l’un des constituants entrant dans la recette du béton. Il n’est jamais utilisé seul et se présente sous la forme d’une poudre fine, grise ou blanche dans le cas du ciment blanc. Il est vendu en sacs de ciment ou en vrac.
Complément : 📄 Document n°1 : Le ciment de Portland
Le ciment Portland (ainsi nommé car il possède une teinte grise très proche de celle des pierres que l'on peut trouver dans la presqu'île de Portland en Angleterre) est le plus utilisé actuellement dans le bâtiment et le génie civil.
Il est composé d'environ 80% de calcaire \(\left( \, \ce{CaCO3} \, \right)\) et 20 % d’argile. L'argile apporte la silice \(\left( \, \ce{SiO2} \, \right)\), l'alumine \(\left( \, \ce{A\ell_2O3} \, \right)\) et l’oxyde de fer \(\left( \, \ce{Fe2O3} \, \right)\).
Le calcaire et l’argile sont généralement extraits des carrières à ciel ouvert situées à proximité de la cimenterie puis concassés en blocs de taille inférieure à \(150\, \mathrm{mm}\).
Complément : 📄 Document n°2 : Obtention du cru
Le but pour la cimenterie (les cimentiers) est d’obtenir un mélange homogène appelé « cru » ou « farine » sous forme de poudre très fine (de diamètre inférieur à \(200\, \mathrm{\mu m}\)) possédant une composition fixe (bien que variant légèrement selon les cimenteries et de son usage). La composition du cru pour la fabrication du ciment reste habituellement dans les proportions suivantes :
Carbonate de calcium (calcaire) \(\left( \, \ce{CaCO3} \, \right)\) : de 77 à 83 % ;
Silice \(\left( \, \ce{SiO2} \right)\) : de 13 à 14% ;
Alumine \(\left( \, \ce{A\ell_2O3} \, \right)\) : de 2 à 4% ;
Oxyde de fer \(\left( \, \ce{Fe2O3} \, \right)\) : de 1,5 à 3 %. (ce sont ces oxydes qui donnent au ciment Portland sa couleur grise).
Question⚓
Q10. Qu’apporte chacune de ces deux matières premières ?
Solution⚓
Q10.
Le calcaire apporte du calcaire, de formule \(\ce{CaCO3}\). Son petit nom scientifique est le carbonate de calcium.
L’argile apporte un mélange d’espèces chimiques :
du \(\ce{Fe2O3}\), un oxyde de fer ;
de la silice, \(\ce{SiO2}\), un oxyde de silicium ;
de l’alumine, \(\ce{A\ell_2O3}\), un oxyde d’aluminium.
On constate encore une fois que les métaux, comme ici \(\ce{Fe}\), \(\ce{Si}\) et \(\ce{A\ell}\), s’oxydent naturellement au contact du dioxygène de l’air. Les métaux dans la nature sont donc trouvés à l’état oxydé : ils forment des oxydes métalliques).
⚙️ Fabrication de la chaux⚓
Complément : 📄 Document n°3 : Obtention de la chaux vive
Les fours utilisés pour l’obtention du clinker sont de forme cylindrique, ils tournent lentement à 2 ou 3 tours par minute et sont longs d’environ 100 mètres et de diamètre environ 5 mètres. Ils sont légèrement inclinés par rapport à l'horizontale de telle sorte que le cru entre par la partie la plus haute du four. Le brûleur est situé au fond du four et produit une flamme à environ 2000°C. Il s’établit un gradient thermique entre l’entrée du four et la sortie de celui-ci de 800°C à 1 500°C environ. Avant d’entrer dans le four, le cru sous forme de poudre traverse un échangeur de chaleur dans lequel circulent en sens inverse les gaz très chauds qui s’échappent du four. Le cru est donc préchauffé à une température d’environ 800°C quand il atteint le début du four. La durée de séjour dans le four est d'environ une demi-heure.
À partir de 650°C environ, la première réaction de transformation (clinkérisation) commence à se produire :
La calcination (chauffage) du calcaire entraîne sa décarbonatation (dégagement de dioxyde de carbone \(\ce{CO2}\)) avec la formation de chaux vive (oxyde de calcium); cette réaction s'effectue à une température voisine de 900°C et s'accompagne d'une perte de masse d'environ 45 %.
Question⚓
Q11. Écrire l'équation de la réaction de décarbonatation du calcaire. Donner ensuite la formule chimique de la chaux vive.
Solution⚓
Q11.
Il est précisé qu’une décarbonatation correspond à un dégagement de dioxyde de carbone à partir de la calcination du calcaire. Dans l’équation de réaction, le calcaire se situe donc à gauche dans l’équation et le \(\ce{CO2}\) produit, à droite. Il vient :
\(\ce{CaCO3 -> CO2 + CaO}\)
Par déduction, l’autre produit formé a pour formule chimique \(\ce{CaO}\). Il s’agit d’un oxyde de calcium, appelé plus communément de la chaux vive.
Question⚓
On donne les masses molaires atomiques : \(M\left(\ce{C}\right)=12,0\ \mathrm{g \cdot mol^{-1}}\) ; \(M\left(\ce{O}\right)=16,0\ \mathrm{g \cdot mol^{-1}}\); \(M\left(\ce{Ca}\right)=40,1\ \mathrm{g \cdot mol^{-1}}\).
L'équation de la réaction nous montre ceci : \(\ce{\color{red}{\mathbf{1}} CaCO3 -> \color{red}{\mathbf{1}} CO2 + \color{red}{\mathbf{1}} CaO}\)
Donc, on a 1 mol de \(\ce{CaCO3}\) qui permet de fabriquer 1 mol de \(\ce{CaO}\), et produit 1 mol de\( \ce{CO2}\).
Pour rappel, la mole (mol) est un paquet en chimie contenant toujours le même nombre de constituants. Ces constituants sont des espèces chimiques. Donc en fonction de la masse de l’espèce contenue, toutes les moles n’ont pas la même masse.
Q12. En vous aidant du complément « À savoir » ci-après, montrer que l'équation de décarbonatation du calcaire permet de justifier la perte relative de 45 % en masse du solide.
Solution⚓
Q12.
\(M(\ce{CaCO3}) = M(\ce{Ca}) + M(\ce{C}) + 3\times M(\ce{O}) = 40,1 + 12 + 3\times 16 = 100,1\ \mathrm{g/mol}\) : \(1 \ \mathrm{mol}\) de \(\ce{CaCO3}\) pèse \(100,1 \ \mathrm{g}\).
\(M(\ce{CO2}) = M(\ce{C}) + 2 \cdot M(\ce{O}) = 12 + 2 \cdot 16 = 44 \ \mathrm{g/mol}\) : \(1 \ \mathrm{mol}\) de \(\ce{CO2}\) pèse \(44 \ \mathrm{g}\).
\(1 \ \mathrm{mol}\) de \(\ce{CaCO3}\) produit \(1\ \mathrm{mol}\) de \(\ce{CO2}\) donc \(100,1 \ \mathrm{g}\) de \(\ce{CaCO3}\) produisent \(44 \ \mathrm{g}\) de \(\ce{CO2}\).
\(\dfrac{44}{100,1} \approx 0,44 = 44 \%\) : La calcination du calcaire produit \(44 \%\) en masse de \(\ce{CO2}\).
Complément : 📌 (À savoir) La mole et la masse molaire
Pour comprendre la masse molaire
Regarder la vidéo suivante :
Masse molaire
La masse d’une mole s’appelle la masse molaire, notée \(M\). Elle s’exprime en \(\mathrm{g/mol}\).
La masse molaire d’une espèce chimique (la masse du paquet) s’obtient en additionnant les masses molaires atomiques de chacun des éléments chimiques constituants l’espèce chimique.
Question⚓
Q13. Vérifier l’affirmation de la vidéo, à savoir que « la production d’une tonne de clinker (chaux vive pour l’instant), produit \(525\ \mathrm{kg}\) de gaz à effet de serre »
.
Solution⚓
Q13.
En prolongeant la réponse à la question précédente, à savoir que La calcination du calcaire produit \(44 \%\) en masse de \(\ce{CO2}\), cela implique que l’on produit \(66 \%\) de chaux vive, c’est-à-dire de clinker.
Mathématiquement, cela peut s’écrire de la sorte : \(0,66 \times m(\ce{CaCO3}) = m(\ce{CaO})\).
Par retournement de formule, il vient : \(m(\ce{CaCO3}) = \dfrac{m(\ce{CaO})}{0,66}\).
Donc 1 tonne (1 000 kg) de chaux vive \(m(\ce{CaO})\) est produite à partir de \(\dfrac{1\ 000}{0,66}\ \mathrm{kg} = 1\ 515 \ \mathrm{kg}\) de \(\ce{CaCO3}\).
Par soustraction, le complément produit étant du \(\ce{CO2}\), \(1\ 515 \ \mathrm{kg}\) de \(\ce{CaCO3}\) produisent donc \(1\ 515 - 1\ 000 = 515 \ \mathrm{kg}\) de \(\ce{CO2}\), qui est un gaz à effet de serre.
Complément : 📄 Document n°4 : Obtention de chaux éteinte pour commercialisation
La chaux vive correspond à la forme la plus dangereuse du matériau, avide d’eau, elle brûle tout corps organique en captant son eau.
Cette chaux peut être éteinte, lors de l'opération d'extinction ou d'hydratation, en ajoutant de l'eau \(\left(\ce{H2O}\right)\) :
en quantité limitée, contrôlée : l'extinction produit une chaux en poudre ;
avec un léger excès d'eau : l'extinction produit une chaux en pâte.
La chaux éteinte en poudre est de l’hydroxyde de calcium \(\left( \ce{Ca(OH)2}\right)\) solide (on l’appelle également chaux aérienne).
Question⚓
Q14. Écrire l'équation (et l’équilibrer) de la réaction de formation de la chaux éteinte, à partir de la chaux vive.
Solution⚓
Q14.
La réaction de la chaux vive de formule \(\ce{CaO}\) avec de l’eau, de formule \(\ce{H2O}\), produit de la chaux éteinte, de formule \(\ce{Ca(OH)2}\). \(\ce{CaO}\) et \(\ce{H2O}\) se situent à gauche dans l’équation. \(\ce{Ca(OH)2}\) se situe à droite.
\(\ce{CaO + H2O -> Ca(OH)2}\) (Cette équation est automatiquement équilibrée).
Question⚓
Q15. Calculer le volume minimal d'eau nécessaire à l'extinction d'une tonne de chaux vive, sachant que la masse volumique de l’eau est de \(1\ 000\ \mathrm{kg\cdot m^{-3}}\).
Données - Masses molaires atomiques :
\(M\left(\ce{C}\right)=12,0\ \mathrm{g \cdot mol^{-1}}\)
\(M\left(\ce{O}\right)=16,0\ \mathrm{g \cdot mol^{-1}}\)
\(M\left(\ce{Ca}\right)=40,1\ \mathrm{g \cdot mol^{-1}}\)
\(M\left(\ce{H2O}\right)=2\times 1,0 + 16,0 = 18,0\ \mathrm{g \cdot mol^{-1}}\)
\(M\left(\ce{CaO}\right)=40,1 + 16,0 = 56,1\ \mathrm{g \cdot mol^{-1}}\)
Solution⚓
Q15.
On reprend le même raisonnement qu’à la question Q13.
L'équation de la réaction nous montre ceci : \(\ce{\color{red}{\mathbf{1\ }} CaO + \color{red}{\mathbf{1\ }} H2O -> \color{red}{\mathbf{1\ }} Ca(OH)2}\)
Donc, on a 1 mol de \(\ce{CaO}\) qui réagit avec 1 mol d'eau et produit 1 mol de\( \ce{Ca(OH)2}\).
Écrit autrement, pour éteindre 1 mol de chaux vive il faut ajouter 1 mol d’eau.
Comme \(M\left(\ce{CaO}\right)=40,1 + 16,0 = 56,1\ \mathrm{g \cdot mol^{-1}}\) et \(M\left(\ce{H2O}\right)=2\times 1,0 + 16,0 = 18,0\ \mathrm{g \cdot mol^{-1}}\), alors, pour éteindre \(56,1\ \mathrm{g}\) de chaux vive il faut introduire \(18\ \mathrm{g}\) d’eau.
Donc pour éteindre 1 tonne de chaux vive, soit \(1\ 000\ \mathrm{kg}\) de chaux vive, il faut introduire \(\dfrac{1\ 000 \times 0,018}{0,0561 }= 320,9 kg\) d'eau (produit en croix lié aux proportionnalités).
Pour finir, il suffit de passer cette masse en volume. On sait que la masse volumique de l’eau est de \(1\ 000\ \mathrm{kg\cdot m^{-3}}=1\ \mathrm{kg\cdot L^{-1}}\).
Donc \(320,9 \ \mathrm{kg}\) d’eau possèdent un volume de :
\(\dfrac{1 \times 320,9}{1} = 320,9\ \mathrm{L}\) (produit en croix entre le volume et la masse).
⚙️ Fabrication du ciment (ou de la chaux hydraulique)⚓
Complément : 📄 Document n°5 : Fabrication du ciment (ou de la chaux hydraulique)… à partir de la chaux vive obtenue et d’argile
La matière première principale du ciment est un mélange de calcaire, de silice, d’argile et d’oxydes de fer. À l’entrée du four, ce mélange est appelé cru. En sortie de four (1 450°C et non 900°C comme pour la chaux) , on obtient le clinker :
Les chaux (hydraulique, grasse, ...) et les ciments sont des mélanges qui varient en fonction des pourcentages massiques des trois composés présents.
Sous l’effet de la chaleur, on observe une scission de l'argile en silice (\(\ce{SiO2}\)), en alumine (\(\ce{A\ell_2O3}\)) et en oxyde de fer (\(\ce{Fe2O3}\)). À partir d’environ 1 300°C les réactions de clinkérisation se poursuivent.
S’ensuivent 3 types de réactions chimiques :
Entre la chaux vive \(\ce{CaO}\) et l’alumine \(\ce{A\ell_2O3}\) ;
Entre la chaux vive \(\ce{CaO}\) et la silice \(\ce{SiO2}\) ;
Entre la chaux vive \(\ce{CaO}\) et l’oxyde de fer \(\ce{Fe2O3}\).
🔖 Réaction entre la chaux vive CaO et l’alumine Al2O3⚓
Question⚓
Q16. Une mole d'aluminate de calcium est formée à partir de trois moles d'oxyde de calcium et d'une mole d'alumine. Donner la formule chimique de l'aluminate de calcium (aussi appelé aluminate tricalcique) après avoir écrit l’équation de réaction.
Solution⚓
Q16.
\(\ce{3 CaO + 1 A\ell_2O3 -> 1\ } \textsf{aluminate de calcium}\)
Par conservation de l’élément chimique, l’aluminate de calcium doit donc contenir \(3\ \ce{Ca}\), \(2\ \ce{A\ell}\) et \(6\ \ce{O}\). Sa formule chimique est donc \(\ce{Ca3A\ell_2O6}\).
⇨ \(\ce{3 CaO +A\ell_2O3 -> Ca3A\ell_2O6}\)
🔖 Réaction entre la chaux vive CaO et la silice SiO2⚓
Complément :
Ce composé nouvellement formé et un autre, constituent la phase liquide du mélange qui continue de progresser vers la partie la plus chaude du four. La silice (\(\ce{SiO2}\).) et la chaux vive ( \(\ce{CaO}\)) restant se dissolvent dans cette phase et réagissent entre-elles pour former de silicate bicalcique de formule \(\ce{Ca2SiO4}\).
Enfin, la troisième phase conduit à la formation d'un silicate tricalcique de formule \(\ce{Ca3SiO5}\), s’il reste de l’oxyde de calcium (\(\ce{CaO}\)) qui n’a pas encore réagi.
Question⚓
Q17. Écrire l'équation de la réaction de formation du silicate bicalcique à partir d'oxyde de calcium et de silice.
Solution⚓
Q17.
La silice (\(\ce{SiO2}\)) et la chaux vive (\(\ce{CaO}\)) réagissent pour former du silicate bicalcique (\(\ce{Ca2SiO4}\)).
\(\ce{SiO2}\) et \(\ce{CaO}\) se retrouvent donc à gauche dans l’équation, \(\ce{Ca2SiO4}\) à droite : \(\ce{SiO2 + CaO -> Ca2SiO4}\)
L'équation n'est pas équilibrée, il suffit de multiplier \(\ce{CaO}\) par 2, ce qui donne : \(\ce{SiO2 + 2\ CaO -> Ca2SiO4}\)
Question⚓
Q18. Proposer une équation pour la réaction de transformation du silicate bicalcique en silicate tricalcique.
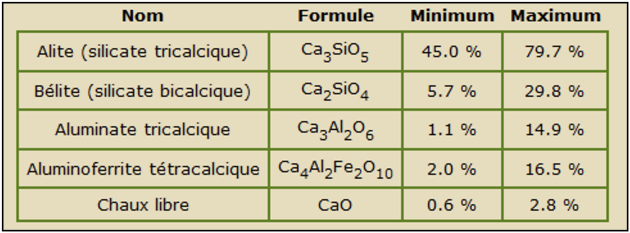
À la sortie du four, les nodules incandescents sont brusquement refroidis à 100°C. La composition minéralogique du clinker est alors la suivante :
Question⚓
Q19. D’où provient l’aluminoferrite tétracalcique composant le ciment ? Ecrire l’équation de réaction.
Solution⚓
Q19.
Dans ce nom, l’aluminoferrite tétracalcique, ultra barbare, on comprend quand même que la molécule en question contient de l’aluminium, du calcium et du fer. Ces 3 atomes provenant de 3 espèces différentes, appelées respectivement oxyde d’aluminium, oxyde de calcium et oxyde de fer, l’obtention de cette molécule provient de la réaction chimique entre ces 3 molécules. Il vient :
\(\ce{4\ CaO + A\ell_2O3 + Fe2O3 -> Ca4A\ell_2Fe2O10}\)
🔖 Obtention du ciment⚓
On ajoute du gypse (minéral de formule \(\ce{CaSO4, 2\ H2O}\)) (3 à 5 %) au clinker refroidi afin d’apporter des sulfates qui permettent de ralentir la prise du ciment puis le tout est broyé en une fine poudre (grains de 40 microns environ), la poudre obtenue est du ciment Portland. Pour obtenir d’autres types de ciments, on mélange avant broyage d’autres composés comme des résidus de la sidérurgie (laitier de hauts fourneaux), des cendres volantes de centrales électriques, etc.
⚙️ Fabrication d'un béton⚓
Complément : 📄 Document n°6 : Fabrication d'un béton
Un béton est un mélange de ciment, de granulats et d’eau. Dans un mortier, le sable assure le rôle des granulats. Sous l’effet du contact avec l’eau, le ciment s’hydrate et durcit pendant la phase que l’on appelle la "prise". Une fois que les réactions d’hydratation sont suffisamment avancées, il y a durcissement du béton, ou du mortier. Ces derniers gardent leurs propriétés mécaniques, même s’ils sont en contact avec le l’eau : ruissellement, immersion...
Le rapport masse d’eau utilisée \(m_\textsf{eau}\) sur masse de ciment utilisée \(m_\textsf{ciment}\) est déterminante sur les caractéristiques mécaniques du béton.
Exemple : 📝 Exemples de formulation : en fonction de la résistance à la compression, de l’ouvrabilité et de la durabilité
Pour \(1\ \mathrm{m^{3}}\) de béton ordinaire (béton 1 :2 :4) :
Ciment :\(350\ \mathrm{kg}\)
Sable : \(700\ \mathrm{kg}\)
Gravier : \(1\ 400\ \mathrm{kg}\)
Eau : \(175\ \mathrm{L}\) (en prenant un rapport E/C de 0,5)
Rapport E/C lie la quantité d’eau en \(\mathrm{L}\) et la masse de ciment
Pour \(1\ \mathrm{m^{3}}\) de béton immergé (par exemple) :
Ciment : 1 part
Sable (granulats fins) : 2 parts
Gravier (granulats grossiers) : 3 parts (parfois légèrement moins pour améliorer l'imperméabilité)
Eau : Généralement autour de 0,45 partie d'eau par partie de ciment (rapport eau/ciment de 0,45)
⚙️ Fabrication d’un mortier⚓
Complément : 📄 Document n°7
La prise du ciment pour fabriquer du mortier s'effectue lorsque l'on verse de l'eau sur un mélange composé de poudre de ciment et de charge/granulats (sable). Le mortier sert souvent de colle.
⚙️ Fabrication d’un béton⚓
Complément : 📄 Document n°8
La fabrication d’un béton se fait en ajoutant des graviers à la place du sable. La prise du ciment c'est-à-dire le passage de la pâte de ciment (ciment + eau) d'une consistance fluide à un état solide est une phase essentielle dans la fabrication du béton puisqu'elle donne sa cohésion au matériau.
La meilleure contribution aux propriétés mécaniques d’un béton est due à l’hydratation des silicates tricalciques. Il constitue ainsi l’ingrédient le plus intéressant. L’augmentation de sa proportion massique dans un clinker a permis de développer des bétons plus performants.
La prise du ciment (transformation en béton) consiste donc en un durcissement du mélange conduisant, à partir du silicate tricalcique (\(\ce{Ca3SiO5}\)) du ciment (pour simplifier les choses, on considèrera que le ciment n’est composé que de silicate tricalcique), à la formation de deux espèces chimiques: le silicate tricalcique hydraté (\(\ce{Ca3Si2O7, 3 H2O}\)) et l'hydroxyde de calcium \(\ce{Ca(OH)2}\) :C’est ça le béton !
Question⚓
Q20. Écrire l'équation de la réaction correspondant à la prise du ciment avec l’eau pour fabriquer du béton.
Solution⚓
Q20.
Dans la fabrication du béton, l’eau et le ciment (\(\ce{Ca3SiO5}\)) sont les réactifs de la réaction. Le béton (le silicate tricalcique hydraté (\(\ce{Ca3Si2O7, 3 H2O}\)) et l'hydroxyde de calcium \(\ce{Ca(OH)2}\) est le produit. On peut alors écrire :
\(\ce{Ca3SiO5 + H2O -> } \left( \ce{Ca3Si2O7, 3H2O} \right) \ce{ + Ca(OH)2}\) : ⚠️ Équation non équilibrée.
On équilibre l'équation : \(\ce{ \color{red}{\mathbf{2\ }} Ca3SiO5 + \color{red}{\mathbf{6\ }} H2O -> Ca3Si2O7, 3H2O + \color{red}{\mathbf{3\ }} Ca(OH)2}\)
Question⚓
Q21. Lorsque la température est inférieure à \(0\ \mathrm{^\circ C}\), pour des raisons non cinétiques, la prise du ciment n'a pas lieu, expliquer pourquoi.
Solution⚓
Q21.
Pour que la réaction précédente de formation du béton ait lieu, il faut que les molécules se rencontrent (physiquement), comme 2 boules de billards qui viendraient se percuter. À l’état liquide, les molécules d’eau sont en perpétuel mouvement. À l’état solide, donc lorsqu’il gèle, les molécules sont liées et ne voyagent plus. Donc s’il gèle, les molécules d’eau ne peuvent plus rencontrer les molécules de ciment, donc la réaction ne peut plus avoir lieu, le ciment ne prend pas.
Complément :
Des adjuvants (facultatifs), produits chimiques, peuvent être ajoutés afin de modifier certaines propriétés du béton (ex : plastifiants, réducteurs d'eau, accélérateurs de prise).