Problématique
Comment les électrons se répartissent-ils autour du noyau ?
Complément : Document 1. Modèle de Bohr et mécanique quantique
Les électrons ne se disposent pas au hasard autour du noyau. En 1913, Niels Bohr suppose qu'ils se situent à des distances particulières. Les zones dans lesquelles on peut trouver les électrons se nomment couches et sous-couches. On les repère à l'aide de chiffres et de lettres.
Les couches sont représentées par un entier positif \(n\). La première couche correspond à \(n= 1\), la deuxième à \(n= 2\), etc. Chaque couche possède une ou plusieurs sous-couches représentées par la lettre \(\ell\) à laquelle sont associées une valeur puis une autre lettre. La première sous-couche se note \(s\) (\(\ell= 0\)), la deuxième \(p\) (\(\ell= 1\)) et la troisième (\(\ell= 2\)) se note \(d\).
Par exemple, si \(n= 3\) et \(\ell= 2\) on parle de la sous-couche \(3d\).
Sur une orbite donnée, les électrons ont une énergie donnée. On parle donc de niveau d'énergie pour chaque sous-couche.
Complément : Document 2. Nombre d'électrons maximum
La couche \(n\) peut contenir \(2n^2\) électrons. Ces électrons se répartissent sur \(n\) sous-couches.
La sous-couche \(\ell\) peut contenir \(2\ell + 1\) paires d'électrons c'est-à-dire \(2\,(\,2\,\ell + 1)\) électrons.
Par exemple, la sous-couche \(3s\) (\(n= 3\) et \(\ell= 0\)) peut contenir \(2\times\left(2 \times 0 + 1\right) = 2\) électrons au maximum.
Complément : Document 3. Remplir les couches et les sous-couches
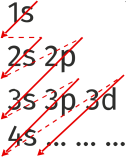
Le remplissage des couches et sous-couches se fait par ordre d'énergie croissante. Il suffit de suivre les flèches rouges de l'image ci-dessus. Cette règle de remplissage est appelée règle de Klechkowski.
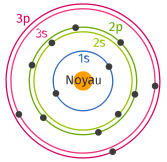
Ci-dessus le modèle de Bohr de l'atome d'aluminium. La configuration électronique de l'aluminium (\(Z= 13\)) s'écrit : \(\color{blue}1s^2 \;\;\color{green}2s^2 \,2p^6 \;\;\color{magenta} 3s^2\, 3p^1.\)
Question⚓
Q2. Combien d'électrons peuvent contenir les sous-couches \(1s\), \(2s\) et \(2p\) ?
Question⚓
Q3. À l'aide de l'exemple de l'aluminium, écrire la configuration électronique du bore \(\mathrm{_5B}\), du carbone \(\mathrm{_6C}\) et du silicium \(\mathrm{_{14}Si}\).
Solution⚓
A1-Q3.
L'atome de bore possède 5 protons, il possède donc 5 électrons.
Sa configuration électronique est : \(\mathrm{1s^2\;\; 2s^2 \:2p^1}\)
L'atome de carbone possède 6 protons, il possède donc 6 électrons.
Sa configuration électronique est : \(\mathrm{1s^2 \;\;2s^2 \:2p^2}\)
L'atome de silicium possède 14 protons, soit 14 électrons.
Sa configuration électronique est : \(\mathrm{1s^2 \;\;2s^2 \:2p^6 \;\;3s^2\: 3p^2}\)
Question⚓
Q4. Quels sont les points communs et les différences entre ces quatre configurations ?
Question⚓
Q5. Où se trouvent les éléments bore, carbone, aluminium et silicium dans la classification périodique[*] ? Préciser les numéros de lignes et de colonnes correspondants.
Question⚓
Q6. Peut-on prévoir la position d'un atome dans la classification grâce à sa configuration électronique et inversement ?
Solution⚓
A1-Q6.
Le numéro de la ligne dans la classification périodique correspond au nombre \(n\) de la couche occupée la plus externe.
Deux éléments situés dans la même colonne ont le même nombre d'électrons sur la couche occupée la plus externe.
La connaissance de la configuration électronique de l'atome permet donc de retrouver sa place dans la classification périodique.
Rappel : Synthèse de l'activité
Q7. Comment écrit-on la configuration électronique d'un atome ? Comment utiliser la classification périodique pour prévoir (ou vérifier) la configuration électronique d'un atome ?