Problématique :
Dans le tableau périodique, les éléments chimiques sont classés par numéro atomique croissant le long d'une ligne (ou période) et par famille dans une colonne.
Comment reconnaît-on une famille chimique ?
1ère partie - Visualisation d'expérience⚓
Complément : La famille des alcalins [Document 1]
Les alcalins sont les éléments de la première colonne de la classification périodique, excepté l'hydrogène.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Complément : Pictogrammes de sécurité [Document 2]
Les pictogrammes de sécurité associés aux éléments alcalins sont :
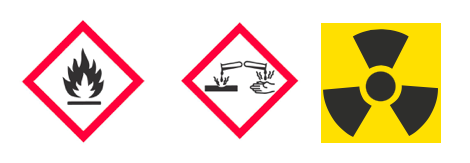
Le dernier pictogramme ne concerne que le césium et le francium.
Complément : Réactivité des dihalogènes [Document 3]
La famille des halogènes se trouve dans la 17ème colonne du tableau périodique. Certaines réactions des dihalogènes peuvent être violentes avec l'aluminium par exemple.
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Questions - 1ère partie⚓
Question⚓
Q1. (Doc.1) Que se passe-t-il quand les alcalins sont au contact de l'air et de l'eau ?
Solution⚓
A4-Q1.
Au contact du dioxygène de l'air, les alcalins s'oxydent. Cette oxydation est d'autant plus vive que l'élément se trouve placé bas dans la première colonne de la classification.
Au contact de l'eau, les métaux alcalins réagissent en formant de la fumée pour le lithium, des flammes pour le sodium, des flammes puis une explosion pour le potassium et une explosion pour le rubidium et le césium. L'explosion du césium est plus impressionnante et s'avère risquée (rupture du cristallisoir contenant l'eau).
Question⚓
Q3. (Doc. 3) Que forme le dichlore \({C\ell}_{2}\) lorsqu'il réagit avec de l'aluminium \({A\ell}\) ? Est-ce le même genre de composé que ceux formés par la réaction avec le dibrome \({Br}_{2}\)ou le diiode \({I}_{2}\) ?
2ème partie - Réalisation de deux expériences⚓
Complément : Réactivité des alcalino-terreux [Document 4]
Expérience n°1
Prendre un tube à essai et le placer sur un support.
Introduire un petit morceau de magnésium dans le tube.
Verser alors quelques mL de la solution d'acide chlorhydrique.
Boucher le tube puis présenter une allumette à l'extrémité de celui‑ci.
Expérience n°2 : Même réaction, mais avec du calcium (et l'acide chlorhydrique)
→ Regarder la vidéo de cette expérience.
Complément : Réactivité des ions halogénures [Document 5]
Expérience n°3
Préparer trois tubes à essai (sur leur support) contenant respectivement \(2 \, mL\) environ d'une des solutions aqueuses suivantes :
chlorure de potassium \(\left ({K}_{\left (aq\right )}^{+}+{C\ell}_{\left (aq\right )}^{-} \right )\)
bromure de potassium \(\left ({K}_{\left (aq\right )}^{+}+{Br}_{\left (aq\right )}^{-} \right )\).
iodure de potassium \(\left ({K}_{\left (aq\right )}^{+}+{I}_{\left (aq\right )}^{-} \right )\).
Ajouter, dans chaque tube, quelques gouttes d'une solution de nitrate d'argent \(\left ({Ag}_{\left (aq\right )}^{+}+N{O}_{3 \; \left (aq\right )}^{-} \right )\).
Observer ce qui se passe dans les 3 tubes à essai.
Complément : Solutions utilisées pour les expériences des Doc. 4 et 5 :
Concentration en masse[*] des solutions :
nitrate d'argent \(\mathrm{ \gamma = 2 \; g/L}\) ;
chlorure de sodium \(\mathrm{ \gamma = 6 \; g/L}\) ;
bromure de potassium \(\mathrm{ \gamma = 12 \; g/L}\) ;
iodure de potassium \(\mathrm{ \gamma = 17 \; g/L}\) ;
acide chlorhydrique \(\mathrm{ \gamma = 36,5 \; g/L}\).
Questions⚓
Question⚓
Q5. (Doc. 4 et 5) Noter vos observations et schématiser ces expériences.
Question⚓
Q6. (Doc. 4 et 5) Après réalisation des expériences, que peut-on constater pour ces éléments ?
Solution⚓
A4-Q6.
On constate que les éléments se trouvant dans une même colonne de la classification périodique ont le même type de réactivité avec un réactif commun.
Autrement dit, ils réagissent de la même manière et forment le même type de produits (ici des précipités) avec le même réactif (ions argent).
Question⚓
Q7. Sachant que l'ion argent \(\mathrm{{Ag}_{\left (aq\right )}^{+}}\) réagit avec les ions chlorure, bromure et iodure, écrire les équations chimiques des transformations chimiques ayant eu lieu dans les 3 tubes à essais.
Solution⚓
A4-Q7.
\(\mathrm{{Ag}_{\left (aq\right )}^{+}+{C\ell}^{-}_{\left (aq\right )} \, \rightarrow \, {AgC\ell}_{\left ( s \right )}}\)
\(\mathrm{{Ag}_{\left (aq\right )}^{+}+{Br}^{-}_{\left (aq\right )} \, \rightarrow \, {AgBr}_{\left ( s \right )}}\)
\(\mathrm{{Ag}_{\left (aq\right )}^{+}+{I}^{-}_{\left (aq\right )} \, \rightarrow \, {AgI}_{\left ( s \right )}}\)
Synthèse de l'activité⚓
Question⚓
Q8. Comment caractériser une famille d'éléments chimiques ? Citez-en trois.