🧪 Ébullition de l'eau pure⚓
Problématique
L'objectif de cette activité est de voir comment varie la température lors d'un changement d'état d'un corps pur. On utilisera ici de l'eau distillée préchauffée à environ \(60\ \mathrm{^\circ C}\).
Méthode : Protocole expérimental simplifié
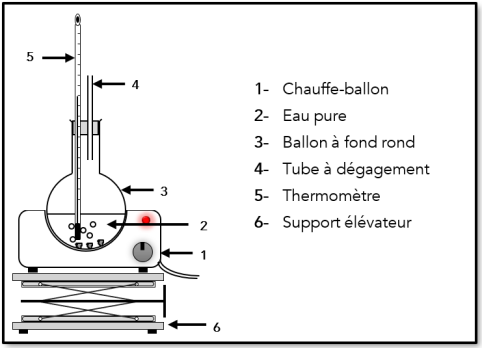
L'idée est ici de chauffer de l'eau pure avec un chauffe-ballon et de mesurer avec un thermomètre à intervalle de temps régulier la température de l'eau pure .
On mesurera encore la température quelques minutes après le début de l'ébullition.
Il faudra ensuite tracer une courbe afin de visualiser la température en fonction du temps. On utilisera un tableau-grapheur (Regressi) sur un ordinateur.
Mettre en œuvre le protocole expérimental (en suivant également les consignes données par le professeur).
Ne pas oublier de faire un tableau de valeur en plus de rentrer les valeurs dans Regressi.
Complément : Schéma du dispositif expérimental
Propriété (À SAVOIR)
🧪 Ébullition de l'eau pure avec un additif : du chlorure de sodium (=sel)⚓
Méthode : Manipulation
Refaire la manipulation précédente en utilisant cette fois-ci de l'eau salée \(\left(\ C_\mathrm{sel}\approx40\ \mathrm{g.L^{-1}}\ \right)\) préchauffée à environ \(60\ \mathrm{^\circ C}\).
Propriété (À SAVOIR)
🧪 Fusion de l'eau pure avec un peu de sel⚓
Méthode : Manipulation
Prendre de la glace pillée (glaçons concassés) dans un bécher. (La glace devra avoir été sortie du congélateur à cet instant)
Placer au centre un thermomètre et noter la température.
Saupoudrer du chlorure de sodium (sel de table) sur la glace et remuer. Noter à nouveau la température.
Renouveler deux ou trois autre fois l'étape de saupoudrage et noter à chaque fois la température.