Complément :
Rappel : La thermodynamique est la science de tous les phénomènes qui dépendent de la température et de ses changements.
🎓 Notion de système⚓
Définition : Système ouvert, fermé, isolé (📌 À SAVOIR) [Document 1]
On appelle système[*] la portion de l'espace limitée par une surface réelle ou fictive, où se situe la matière étudiée. Le reste de l'Univers est le milieu extérieur.
Un système ouvert échange de la matière et de l'énergie avec le milieu extérieur.
Un système fermé échange de l'énergie avec le milieu extérieur.
Un système isolé n'échange ni matière ni énergie avec le milieu extérieur.
Définition : État d'un système – Variables et fonctions d'état (📌 À SAVOIR) [Document 2]
L'état d'un système est défini par des grandeurs appelées variables d'état : si ces variables changent, l'état du système change.
Les autres grandeurs sont des fonctions d'état : leur valeur est fonction (dépend) de l'état du système.
Définition : Rappels sur les propriétés d'un gaz [Document 3]
La pression d'un gaz augmente avec la quantité de matière du gaz et le volume d'un gaz augmente aussi avec la quantité de matière du gaz.
La température, le volume, la pression et la quantité de matière d'un gaz sont des paramètres influant sur l'état d'un gaz.
❔ Questions⚓
Dans les trois exemples ci-dessous, définir le système étudié et préciser son état.
Question⚓
Q2. Dans un calorimètre (enceinte isolée de l'extérieur) contenant initialement une masse d'eau froide
\(\mathrm{m_f=200\,g}\) à la température \(\mathrm{T_f=5,0\,^\circ \text{C}}\), on ajoute une masse d'eau chaude \(\mathrm{m_c=50,0\,g}\) à la température de \(\mathrm{T_c=80,0\,^\circ \text{C}}\).
Solution⚓
Q2. Le système étudié est le calorimètre avec l'eau froide et l'eau chaude. Il s'agit d'un système isolé car il s'agit d'un calorimètre qui est une enceinte adiabatique[*] donc qui n'échange pas d'énergie avec l'extérieur, et il n'y a pas d'échange de matière avec l'extérieur.
Question⚓
Q3. On verse dans une tasse un café à une température \(\mathrm{70\,°C}\). On patiente quelques minutes avant de le consommer qu'il soit à une température plus faible pour ne pas se brûler.
Question⚓
Q4. On fait couler dans une baignoire non bouchée \(\mathrm{110\,L}\) d'eau chaude à une température de \(\mathrm{55\,^\circ \text{C}}\). On ajoute également \(\mathrm{40\,L}\) d'eau froide à \(\mathrm{14\,^\circ \text{C}}\) pour refroidir l'eau plus vite.
🎓 Grandeurs intensives et extensives⚓
Rappel : État d'un système – Variables et fonctions d'état (À SAVOIR) [Document B.1]
Les variables et fonctions d'états sont des grandeurs physiques (avec leurs unités associées) mesurables directement (ou indirectement comme la température).
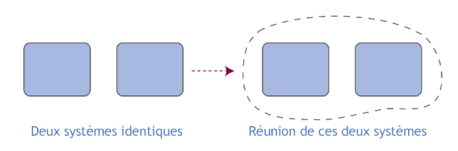
Considérons deux systèmes rigoureusement identiques, et réunissons-les pour en faire un seul.
Certaines variables vont doubler par rapport à chacun des deux systèmes initiaux : on dit qu'il s'agit de variables extensives ;
D'autres variables vont garder la même valeur : on dit qu'il s'agit de variables intensives.
💪 Exercices⚓
Supposons, pour plus de facilité à comprendre, que dans l'exemple du Document 4 on parle de deux systèmes identiques : { Eau salée }.
🎓 Équilibre d'un système⚓
📌 Le premier principe de la thermodynamique⚓
📍 L'énergie interne⚓
Complément : Système ouvert, fermé, isolé (📌 À SAVOIR) [Document 5]
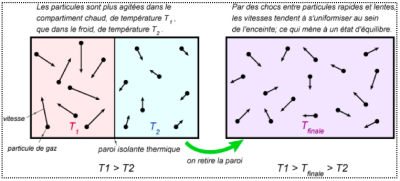
Les particules constituant un corps sont agitées (selon la température). De ce fait elles possèdent une énergie cinétique.
D'autre part elles interagissent entre elles : elles sont liées par des liaisons chimiques et s'attirent par des forces électriques.
De ce fait elles possèdent une énergie appelée énergie potentielle d'interaction.
La somme de l'énergie cinétique d'agitation des particules et de l'énergie potentielle d'interaction entre ces particules est appelée énergie interne, notée \(\mathrm{U}\). |
💪 Exercices⚓
Question⚓
Q11. Quelle analogie peut-on faire entre l'énergie mécanique \(\mathrm{E_{m}}\) et l'énergie interne \(\mathrm{U}\) d'un système ?
📍 La variation d'énergie interne⚓
Complément : Variation d'énergie interne [Document 6]
Devant la complexité de devoir tenir compte de toutes les interactions microscopiques, la valeur de l'énergie interne \(\mathrm{U}\) d'un système n'est ni mesurable ni calculable. Seule la variation d'énergie interne \(\mathrm{\Delta U}\), dépendant uniquement de l'état initial et final du système, sera étudiée.
Complément : Le premier principe [Document 7]
La variation d'énergie interne peut se faire par deux types d'échanges d'énergie :
un échange d'énergie avec l'extérieur par travail \(\mathrm{W}\).
un échange d'énergie avec l'extérieur par transfert thermique \(\mathrm{Q}\).
On écrit alors : \(\boxed{\mathrm{\Delta U=W+Q}}\)
Par convention, le travail et le transfert thermique sont comptés positivement s'ils sont reçus par le système et négativement s'ils sont perdus par le système.
💪 Exercices⚓
Question⚓
Q14. Que peut-on dire de la variation d'énergie interne lorsque l'on considère un système isolé constitué de plusieurs sous-systèmes ?
Question⚓
Q15. Que peut-on dire de l'énergie interne de l'Univers entier ?
Question⚓
Q16. Que faut-il pour que la variation d'énergie interne \(\mathrm{\Delta U}\) augmente pour un système fermé ?
🏋️♂️ Exercice⚓
On considère un système qui échange de l'énergie avec l'extérieur. On représente sur le schéma ci-contre ces transferts.
On donne :
\(\mathrm{\left | W \right |=200\:J}\)
\(\mathrm{\left | Q_1 \right |=80\:J}\)
\(\mathrm{\left | Q_2 \right |=100\:J}\)
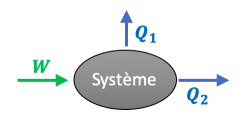
Question⚓
Q18. Calculer la variation d'énergie interne \(\mathrm{\Delta U}\) du système. Conclure.