Pour répondre aux questions il faudra lire les différents documents et utiliser ses connaissances.
Il faudra être le plus autonome possible. Bien entendu votre professeur sera là pour vous aider et vous guider.
Introduction
La température, c'est une notion que tout le monde connait, ou plutôt pense connaître. Savez-vous ce qu'est-ce qu'est réellement cette notion de température ?
Essayer de vous l'expliquer avant de continuer.
📌 Quelques définitions⚓
Définition : Thermodynamique
La thermodynamique est la science de tous les phénomènes qui dépendent de la température et de ses changements.
Définition : Température
La température est une grandeur physique[*] qui intervient dans tous les domaines de la science.
Elle agit sur de nombreuses propriétés de la matière : dilatation des structures en béton l'été, congélation de l'eau l'hiver, etc.
📖 Une origine physiologique⚓
De manière naturelle, l'être humain est sensible à la sensation de chaud et de froid.
Cette sensation dépend de l'état physiologique du sujet, de ses sensations antérieures.
Cette sensation dépend aussi des propriétés de la matière.
Complément :
Cela est donc très qualitatif et les physiciens ont introduit la notion de température pour essayer de quantifier l'intensité de ces sensations.
📄 La température : un paramètre intensif (+ Petite Expérience)⚓
Complément : Document n°1 : Extensivité et intensivité en physique
Les grandeurs extensives et intensives sont des catégories de grandeurs physiques d'un système physique :
une propriété est « extensive » si elle est proportionnelle à une quantité caractéristique du système : par exemple, la masse ou le volume.
une propriété est « intensive » si sa valeur ne dépend pas de la taille du système (en particulier, si sa valeur est la même en tout point d'un système homogène) : par exemple, la température ou la pression ;
Autrement dit, une grandeur physique G est dite intensive si et seulement si sa valeur reste identique pour toute partie d'un système homogène.
(Et réciproquement, on qualifie un système d'homogène si toutes les grandeurs intensives considérées y prennent une valeur identique dans toutes ses sous-parties.)
Exemple :
Si deux chevaux courent côte à côte et chacun à 60 km/h, à eux deux, ils font un ensemble allant aussi à 60 km/h (la vitesse est intensive), cependant, à eux deux, ils font un passage deux fois plus imposant qu'un cheval seul (débit, puissance et masse sont doublés : ce sont des grandeurs extensives).
Source : Wikipedia
Petite expérience
Question⚓
Q5. À l'aide du matériel à disposition, proposer et réaliser un protocole expérimental (Le protocole doit être clair et précis et peut-être avantageusement accompagné d'un schéma), permettant de mesurer la température d'un mélange de deux volumes identiques d'eau à des températures différentes.
Veiller à ce que le thermomètre ne soit pas en contact avec les parois du récipient.
Il faudra utiliser deux manières différentes pour mesurer la température puis conclure.
Exploitation⚓
🔬 Approche microscopique⚓
Complément : Document n°2 : L'énergie cinétique microscopique
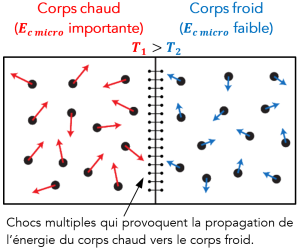
Les particules d'un système, quel que soit son état physique, sont en mouvement désordonné. Ce mouvement, appelé agitation thermique, est mesuré à l'échelle macroscopique par la température.
Plus la température d'un corps est élevée, plus l'agitation thermique des particules qui le constituent est importante et plus leur énergie cinétique[*] microscopique[*] est grande.
On notera l'énergie cinétique microscopique \(E_{c\, micro}\).
Question⚓
Q11. Même question entre un iceberg à –10 °C et de l'hélium liquide à –269 °C ?
🌡 Les échelles de températures⚓
Les températures sont repérées par une échelle (le zéro a été défini de manière conventionnelle aux débuts).
Complément : Document n°3 : L'échelle Fahrenheit (1724)
La première échelle de température est due à un physicien allemand nommé Gabriel Fahrenheit (1686–1736). Elle était basée sur des références d'une précision très relative :
La valeur \(\mathrm{\theta=0\,^\circ \text{F}}\) pour le phénomène de solidification d'un mélange eau/chlorure d'ammonium.
La valeur \(\mathrm{\theta=96\,^\circ \text{F}}\) étant défini comme la température du sang du cheval.

Gabriel Fahrenheit (1686 – 1736)
Complément : Document n°4 : L'échelle Celsius (1742)
L'échelle Celsius est également une échelle empirique qui s'appuie sur l'expérience et non sur la théorie.
Arbitrairement, il a été défini par :
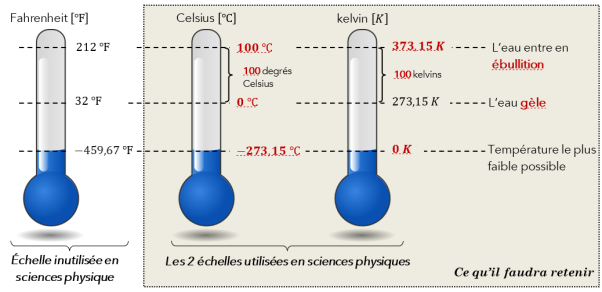
la valeur \(\mathrm{\theta=0\,^\circ \text{C}}\) pour le phénomène de solidification de l'eau pure (à pression atmosphérique)
la valeur \(\mathrm{\theta=100\,^\circ \text{C}}\) pour le phénomène d'ébullition de l'eau pure (à pression atmosphérique)
Complément : Document n°5 : L'échelle absolue dite de Kelvin (1848)
Le kelvin (symbole K, du nom de William Thomson dit Lord Kelvin physicien et mathématicien écossais), est l'unité de base SI de température thermodynamique.
À la différence du degré Celsius, le kelvin est une mesure absolue de la température qui a été introduite grâce au troisième principe de la thermodynamique. La température de \(0 K\) est égale à \(-273,15 ^\circ \text{C}\) et correspond au zéro.
Le kelvin, n'étant pas une mesure relative, n'est jamais précédé du mot « degré » ni du symbole « ° », contrairement aux degrés Celsius ou Fahrenheit.
Les écarts de température sont identiques en kelvin et en degré Celsius.
Attention :
Par convention, les noms d'unité sont des noms communs et s'écrivent en minuscule (« kelvin » et non « Kelvin »).
Complément : Document n°6 : Comment « Lord Kelvin » a-t-il construit son échelle de température ?
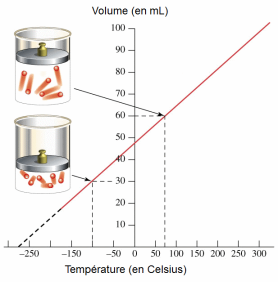
Le physicien français Jacques Charles a démontré qu'il existe une relation entre le volume et la température d'un gaz. Il a établi que, à pression constante et pour une quantité de matière donnée, le volume d'un gaz varie en fonction de sa température.
Du point de vue microscopique plus le degré d'agitation des molécules augmente, et si celles-ci ne sont pas limitées dans leurs déplacements par les parois d'un récipient, plus ces molécules occuperont de l'espace.
On doit donc admettre que plus la température augmente, plus le volume augmente. Il en est aussi vrai pour le contraire : plus la température diminue, plus le volume diminue.
Cette relation se nomme la loi de Charles :
Lien et QR-Code pour l'animation ci-dessous (en grand format) :
https://dgxy.link/VdNqH 
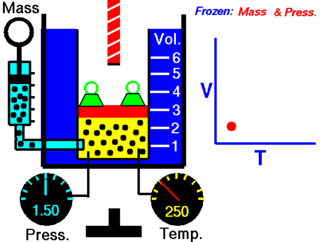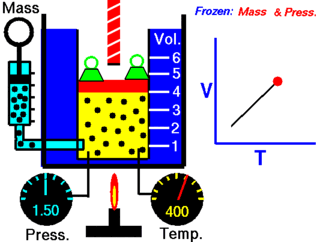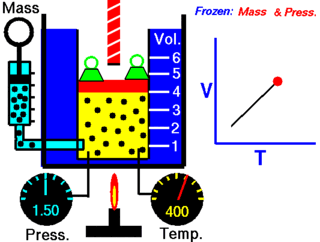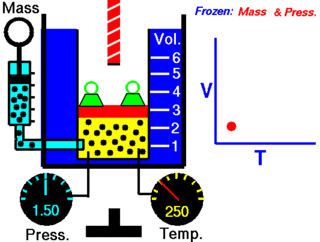
Cependant, cette relation n'est pas directement proportionnelle puisque *****************************************************************. Si la droite passait *********************, cela indiquerait qu'aucun gaz n'existe à une température de 0 °C, ce qui n'est heureusement pas le cas.
Lord Kelvin se pose alors la question suivante :
« Si le volume d'un gaz diminue avec la baisse de la température, existe-t-il une valeur de température où le volume du gaz sera nul ou égal à 0 ? »
L'extrapolation de la droite montre un volume qui semble nul à une température de –273,15 °C. Cette observation se répète quelle que soit la nature du gaz considéré. Cette température serait donc le zéro absolu, c'est-à-dire la température au-delà de laquelle la matière n'existerait plus. Il y aurait alors absence de mouvement des particules de matière et une énergie cinétique nulle.
Note :
La loi a été publiée pour la première fois par Louis Joseph Gay-Lussac en 1802, mais elle avait été découverte par Jacques Charles dès 1787. Cette loi peut donc occasionnellement être appelée loi de Gay-Lussac. Néanmoins, le nom de loi de Gay-Lussac est plutôt réservé à la formule reliant pression et température d'un gaz parfait à volume constant.
Avez-vous bien compris ?⚓