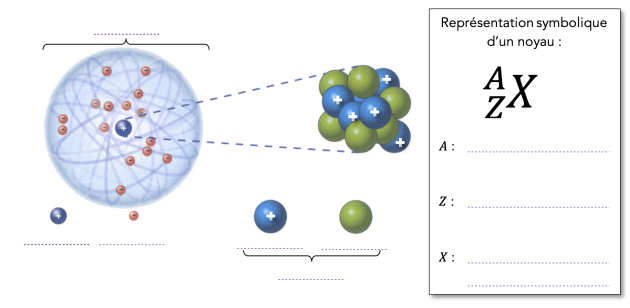
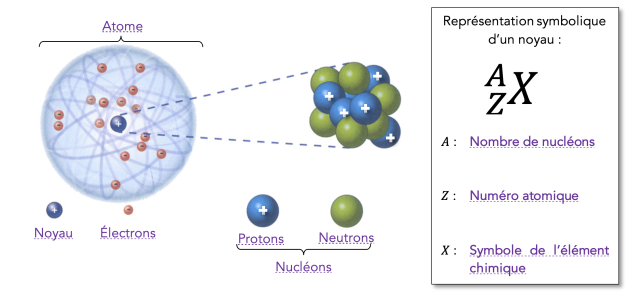
🔖 Structure de l'atome (Rappels)⚓
🔖 Stabilité d'un atome⚓
Complément : 📄 Document n°1 : Stabilité d’un atome
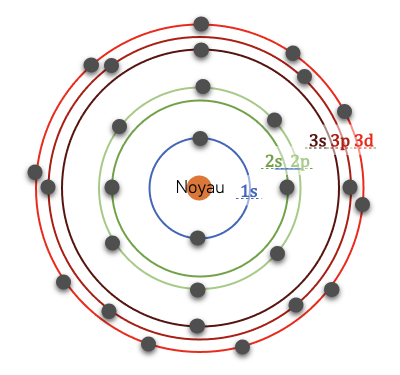
La stabilité d’un atome est maximale lorsqu’il respecte la règle de l’octet (ou du duet pour la couche 1s). Ainsi les atomes vont chercher à obtenir 8 électrons de valence (ou 2 pour la couche \(1s\)).
Complément : 📄 Document n°2 : Les ions (Rappels)
Un ion est un atome qui a échangé des électrons avec son environnement. Alors que l’atome est toujours neutre, l’ion possède obligatoirement une charge électrique indiquée en exposant du symbole de l’élément chimique. Ainsi en fonction du nombre d’électrons de valence possédé par l’atome il va devenir :
un ion positif, ou cation, en perdant un ou plusieurs électrons ;
un ion négatif, ou anion, en gagnant un ou plusieurs électrons.
Complément : 📄 Document n°3 : La liaison covalente
Une liaison covalente est une liaison chimique forte entre deux atomes résultant de la mise en commun de deux électrons de valence provenant séparément de chacun des deux atomes. Ces deux électrons sont appelés doublet liant. Ainsi un atome établissant une liaison covalente avec un autre possède un électron supplémentaire sur sa couche de valence.
❓ Questions d'après les documents⚓
D'après le Doc.2
Question⚓
Q10. Afin de gagner en stabilité et respecter la règle de l’octet, les atomes ci-dessous vont se transformer en ion. Donner la structure électronique de l’atome ainsi que la formule de l’ion associé à cet atome. Justifier.
Atomes qui se transforment en ions : \(\large \hspace{3mm} _{9}\textrm{F} \hspace{3mm} ; \hspace{3mm} _{20}\textrm{Ca} \hspace{3mm} ; \hspace{3mm} _{4}\textrm{Be}\)
Solution⚓
Q10.

Réponse :
La structure électronique de cet atome est : \(\mathrm{1s^2\ 2s^2 2p^5}\). Il a donc \(5+2=7\) électrons sur sa couche externe qui est aussi sa couche de valence.
Il lui manque 1 électron pour satisfaire à la règle de l'octet (son n° atomique est >5).
Il gagnera donc 1 électron pour devenir un ion négatif, appelé anion.
Sa formule sera donc \(\mathrm{F^-}\) et la structure électronique sera \(\mathrm{1s^2\ \ 2s^2\ 2p^6}\).
Ce QR-Code vous amènera vers la une petite vidéo expliquant la rédaction de la réponse précédente.
Vous pouvez également cliquer sur ce lien.
Les solutions ci-dessous est volontairement très raccourcies... Vous devez rédiger des explications et donc des réponses plus longues, à l'image de l'exemple précédent.
\(\large _{20}\mathrm{Ca}\)
\(1s^2\ \ 2s^2 2p^6\ \ 3s^2 3p^6\ \ 4s^2\)
Perte de deux \(e^-\) pour satisfaire la règle de l’octet, donc formation d’un cation : \(\ce{Ca^{2+}} : 1s^2\ \ 2s^2 2p^6\ \ 3s^2 3p^6\)
\(\large _{4}\mathrm{Be}\)
\(1s^2\ \ 2s^2\)
Perte de deux \(e^-\) pour satisfaire la règle du duet, donc formation d’un cation :\(\ce{Be^{2+}} : 1s^2\)
D'après le Doc.3
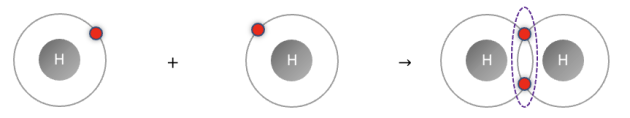
La molécule de dihydrogène \(\ce{H2}\) est constituée de deux atomes d’hydrogène \(\large _{1}\mathrm{H}\) reliés par une liaison covalente.
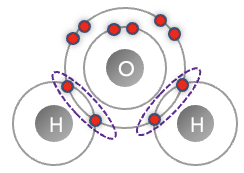
Le schéma ci-dessous symbolise la formation d’une molécule de dihydrogène, où les électrons sont représentés par un point rouge sur leur couche électronique (cercle gris). Le doublet liant formant la liaison covalente est entouré en pointillé.
Question⚓
Q11. Montrer que les atomes d’hydrogène ont gagné en stabilité après la formation de la liaison covalente.
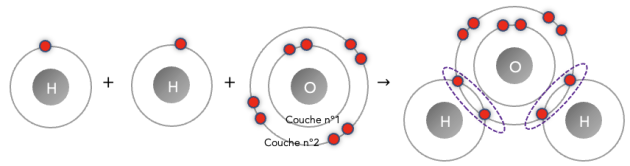
La molécule d’eau \(\ce{H2O}\) est constitué de deux atomes d’hydrogène \(_{1}\mathrm{H}\) et d’un atome d’oxygène \(_{8}\mathrm{O}\). Chaque hydrogène est relié par une liaison covalente à l’oxygène.
Question⚓
Solution⚓
Q12.
Le partage mutuel d’électrons entre un atome d’hydrogène et un atome d’oxygène ajoute, pour chacun d’eux, un électron dans leur couche externe. Ainsi, après avoir réalisé deux liaisons covalentes l’atome d’oxygène possède 8 électrons dans sa couche externe : il a donc bien gagné en stabilité.
Pour les deux atomes d’hydrogène, ils ont 2 électrons sur leur couche externe, donc ont gagné en stabilité (règle du duet).
🔖 La liaison covalente⚓
Dans la représentation précédente de la molécule d’eau, nous avons mis en évidence les deux liaisons covalentes entre l’atome d’oxygène et deux atomes d’hydrogène.
Ces deux liaisons covalentes sont toutes deux constituées de deux électrons de valence, appartenant à chacun des atomes participant à cette liaison.
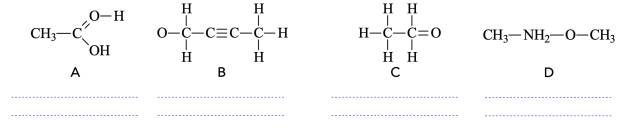
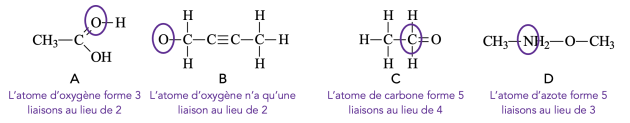
Question⚓
Q13. Compléter le tableau suivant en indiquant la structure électronique de l’atome étudié et le nombre de liaison covalente qu’il cherchera à former pour être le plus stable :
Atome | \(_{1}\mathrm{H}\) | \(_{6}\mathrm{C}\) | \(_{7}\mathrm{N}\) | \(_{8}\mathrm{O}\) | \(_{9}\mathrm{F}\) |
|---|---|---|---|---|---|
Structure électronique de l’atome |
| ||||
Nombre de liaison covalente |
|
Solution⚓
Q13.
Atome | \(_{1}\mathrm{H}\) | \(_{6}\mathrm{C}\) | \(_{7}\mathrm{N}\) | \(_{8}\mathrm{O}\) | \(_{9}\mathrm{F}\) |
|---|---|---|---|---|---|
Structure électronique de l’atome | \(\large \color{blue} 1s^1\) | \(\large \color{blue} 1s^2 \ \ 2s^2 2p^2\) | \(\large \color{blue} 1s^2 \ \ 2s^2 2p^3\) | \(\large \color{blue} 1s^2 \ \ 2s^2 2p^4\) | \(\large \color{blue} 1s^2 \ \ 2s^2 2p^5\) |
Nombre de liaison covalente | \(\large \color{blue} 1\) | \(\large \color{blue} 4\) | \(\large \color{blue} 3\) | \(\large \color{blue} 2\) | \(\large \color{blue} 1\) |
H va former 1 liaison car il lui manque 1 électron pour satisfaire la règle du duet.
C ------------- 4 liaisons --------------------- 4 électrons ------------------ la règle de l’octet.
N ------------- 3 liaisons --------------------- 3 électrons ------------------ la règle de l’octet.
Question⚓
Q14. En conclusion, compléter le tableau ci-dessous :
Manière pour un atome de modifier ses électrons de valence pour respecter la règle de l’octet : | L’atome peut gagner des électrons | L’atome peut perdre des électrons |
|---|---|---|
Se transformer en ______________________________ | ||
Établir des ______________________________ |
Solution⚓
Q14.
Manière pour un atome de modifier ses électrons de valence pour respecter la règle de l’octet : | L’atome peut gagner des électrons | L’atome peut perdre des électrons |
|---|---|---|
Se transformer en \(\color{blue} \textsf{ion (cation ou anion)}\) | \(\color{blue} \textsf{Oui}\) | \(\color{blue} \textsf{Oui}\) |
Établir des \(\color{blue} \textsf{liaisons covalentes}\) | \(\color{blue} \textsf{Oui}\) | \(\color{blue} \textsf{Non}\) |
Définitions à savoir 📌
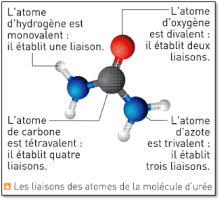
Définition : 📌 La valence d'un atome (À savoir)
Lorsqu’ils se stabilisent en formant des molécules, les atomes doivent former autant de liaisons que d’électrons manquants pour obtenir une structure en duet ou en octet.
Le nombre de liaison covalente que peut former un atome s’appelle la valence de l’atome.
Un atome monovalent est un atome qui établit une liaison covalente.
Un atome divalent est un atome qui établit deux liaisons covalentes.
Un atome trivalent est un atome qui établit trois liaisons covalentes.
Un atome tétravalent est un atome qui établit quatre liaisons covalentes.