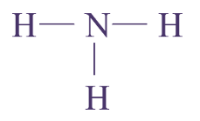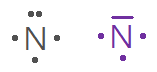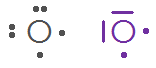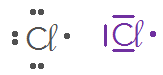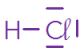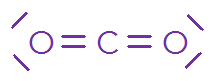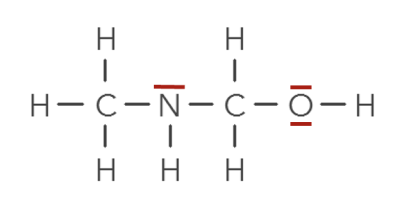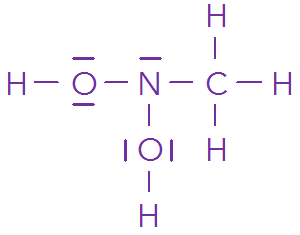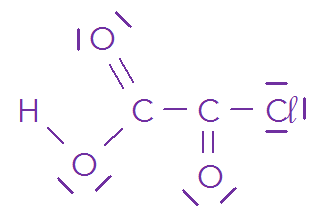🔖 Du modèle moléculaire à la représentation d’une molécule⚓
Complément : Document n°1 : Le premier modèle de liaison chimique
C’est en 1916 que le chimiste américain Gilbert Lewis proposa le 1er vrai modèle de la liaison chimique. Ce modèle découle de la découverte de l’électron quelques années auparavant. Ce modèle est très utile pour le chimiste car il permet de prédire le nombre de liaisons que forme chaque atome et répartit les électrons d’un atome en deux catégories : ceux de cœur, chimiquement inactifs, et ceux de valence (ou externes) […].

🔼 Fig.1 : Gilbert Newton LEWIS (1875-1946)
Comme presque toutes les molécules stables connues à l'époque comportent un nombre pair d'électrons de valence, Lewis postule l'existence de paires électroniques. Les liaisons sont assurées par des paires liantes, mais il existe aussi des « paires libres » qui n'interviennent pas directement.
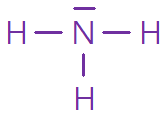
Pour former les liaisons, les atomes mettent en commun des électrons. Le but, pour chaque atome, est d'être entouré de huit électrons (sauf l'hydrogène et l'hélium auxquels deux électrons suffisent) : c'est la règle de l'octet, introduite en 1904 par l'Allemand Richard Abbeg. Ainsi dans la molécule d’eau, formée d'un atome d'oxygène et de deux atomes d'hydrogène, l'oxygène, qui possède six électrons de valence au départ, partage un électron avec chaque atome d'hydrogène. Il se retrouve avec huit électrons de valence, tandis que chaque atome d'hydrogène, avec deux électrons, atteint également son « quota ».
« La physique en 18 mots clés »,La Recherche, hors-série n°1, 2005.
Question⚓
Q6. Comment peut-il obtenir les « 8 électrons de valence » pour satisfaire à la règle de l’octet dans le cas de la molécule d’eau \(\ce{H2O}\) ?
Question⚓
Q9. Quels sont ces électrons mis en jeu ? En reste-t-il une fois les liaisons formées ?
📌 Définition (À retenir)
Question⚓
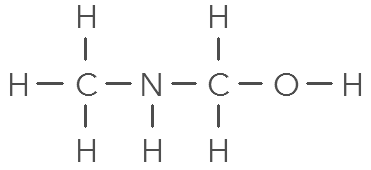
Q12. À l’aide des modèles moléculaires, trouver l’organisation des atomes permettant d’obtenir une molécule stable avec :
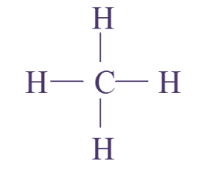
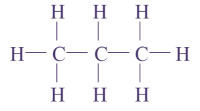
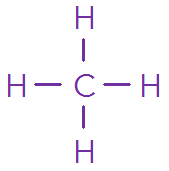
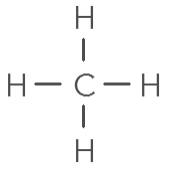
1 C, 4 H : molécule de méthane
3 C, 8 H : molécule de propane
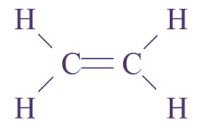
2 C, 4 H : molécule d’éthylène
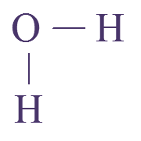
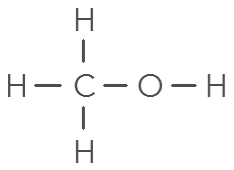
1 O, 2 H : molécule d’eau
1 N, 3 H : molécule d’ammoniac
Question⚓
Q13. Pour chaque molécule, on donnera la formule brute (indiquant la composition) et la formule développée (représentant les atomes par leur symbole et les liaisons les reliant par des tirets sans forcément respecter les directions observées sur le modèle).
🛑 Les limites de la formule développée⚓
Rappel :
On a vu précédemment qu’un atome formait une ou plusieurs liaisons pour se stabiliser en satisfaisant la règle du duet ou de l’octet. Une liaison est définie comme la mise en commun d’électrons entre deux atomes (un électron par atome). Ces électrons mis en commun sont alors comptabilisés pour les deux atomes ayant établi cette liaison.
Question⚓
Q14. Compter le nombre de doublets liants apparaissant autour de chaque atome dans les formules développées des molécules de méthane, d’eau et d’ammoniac.
Question⚓
Q16. Peut-on justifier la stabilité de ces édifices aux vues de la règle de l’octet (et du duet) ?
Exemple :
Dans la formule brute de l’eau, \(\ce{H-O-H}\), les tirets représentent les paires d’électrons partagées par H et O :
\(\ce{H\cdot\cdot O\cdot\cdot H}\) chaque H a 1 électron représenté ; O n'a 2 électrons de valence représentés, alors qu’il en possède 6.
Attention :
Ceci montre bien que la formule développée n'est pas correcte pour représenter tous les électrons de valence d'un atome.
🔖 La représentation de Lewis d’une molécule⚓
Définition : 📌 La représentation de Lewis
La représentation de Lewis d’une molécule fait figurer sur la formule de la molécule tous ses électrons de valence, regroupés par paires appelées doublets qui peuvent être :
Les liaisons covalentes (ou doublet liants) entre les atomes de la molécule.
Les doublets non-liants placés autour de l’atome.
Les liaisons covalentes sont représentées avec un tiret reliant deux atomes, alors que les doublets non-liants sont représentés par un tiret encadrant un atome.
Remarque : Une double liaison comme \(\ce{C=O}\) compte comme deux liaisons covalentes.
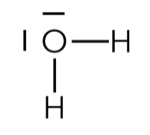
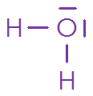
Représentation de Lewis de la molécule d’eau
Méthode : Comment faire la représentation de Lewis d’un atome ?
Pour déterminer la représentation de Lewis d’un atome, il faut :
Connaitre le nombre d’électron de valence de l’atome.
Écrire le symbole de l’atome et placer les électrons de valence, un par un, « en tournant » autour du symbole de l’atome selon les quatre directions : haut, gauche, bas et droite. Plusieurs tours autour du symbole de l’atome peuvent être réalisés.
Deux électrons au même endroit forment un doublet non liant et ne sont pas disponibles pour former une liaison covalente. On les représente par un tiret autour du symbole de l’atome.
Un électron seul est un électron célibataire, disponible pour former une liaison covalente.
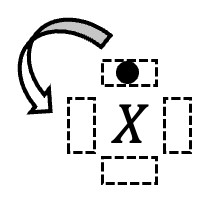
Les électrons sont placés un par un en tournant autour de l’atome
Méthode : Comment faire la représentation de Lewis d’une molécule ?
Pour déterminer la représentation de Lewis d’une molécule, il faut :
Connaitre la représentation de Lewis de chaque atome constituant la molécule.
Les électrons célibataires d’un atome s’associent avec les électrons célibataires d’un autre atome pour former des doublets liants, représentant la liaison covalente. Elle est schématisée par un tiret entre les deux atomes.
Représenter la molécule en formule développée en schématisant les doublet liants et non liants.
Question⚓
Q18. Donner la représentation de Lewis des atomes suivants :
Atome | \(_{1}\mathrm{H}\) | \(_{6}\mathrm{C}\) | \(_{7}\mathrm{N}\) | \(_{8}\mathrm{O}\) | \(_{17}\mathrm{C\ell}\) |
|---|---|---|---|---|---|
Nombre d’électron de valence | |||||
Représentation de Lewis |
| ||||
Nombre d’électron célibataire | |||||
Nombre de doublet non liant |
Question⚓
Q19. Donner (ou compléter) la représentation de Lewis des molécules suivantes :
Molécule | \(\ce{HC\ell }\) | \(\ce{ H2O}\) | \(\ce{CH4 }\) | \(\ce{CO2 }\) | \(\ce{NH3 }\) |
|---|---|---|---|---|---|
Représentation de Lewis |
|
🏋️ Petits exercices⚓
Question⚓
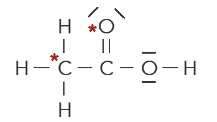
Q20. Dans les représentations de Lewis ci-dessous, montrer que les atomes ayant un astérisque * respectent la règle de l’octet.
\(\ce{CH3-COOH}\)
\(\ce{C\ell-CH2-NH2}\)
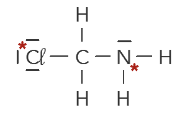
Solution⚓
Q20.
\(\ce{CH3-COOH}\)

L’atome de carbone possède 4 liaisons covalentes autour de lui, donc possède 2\times4=8 électrons de valence, donc il respecte bien la règle de l’octet.
L’atome d’oxygène possède 2 liaisons covalentes autour de lui et deux doublets non-liants. Donc il possède \(2\times2+2\times2=8\) électrons de valence, donc il respecte bien la règle de l’octet.
\(\ce{C\ell-CH2-NH2}\)
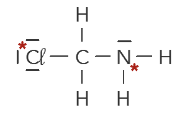
L’atome de chlore possède 1 liaisons covalentes autour de lui et trois doublets non-liants. Il possède donc \(1\times2+3\times2=8\) électrons de valence, donc il respecte bien la règle de l’octet.
L’atome d’azote possède 3 liaisons covalentes autour de lui et un doublet non-liant. Donc il possède \(3\times2+1\times2=8\) électrons de valence, donc il respecte bien la règle de l’octet.