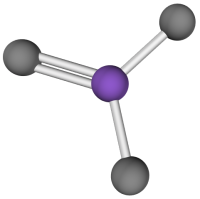
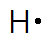La géométrie d’une molécule désigne la disposition en trois dimensions des atomes la constituant. Elle détermine plusieurs de ses propriétés comme sa réactivité, sa polarité, sa couleur, son activité biologique, … Comment peut-on prévoir la géométrie d’une molécule ?
🔖 Rappels⚓
Complément : 📄 Document n°1 : Représentation de Lewis d’un atome et d’une molécule
La représentation de Lewis est une représentation de la structure électronique externe des atomes. Inventée par le chimiste Gilbert Lewis au début du XXème siècle, elle permet d’expliquer l’agencement des atomes constituant une molécule et la disposition des différentes liaisons covalentes.
On symbolise autour de l’atome les électrons célibataires par un point et les doublets non liant par un tiret.
Quelques exemples de représentation de Lewis d’atomes usuels :
Hydrogène | Carbone | Azote | Oxygène | Fluor |
|---|---|---|---|---|
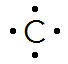 |  | 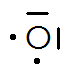 |  |
Pour déterminer la représentation de Lewis d’une molécule, il faut :
Connaitre la représentation de Lewis de chaque atome constituant la molécule.
Les électrons célibataires d’un atome s’associent avec les électrons célibataires d’un autre atome pour former des doublets liants, représentant la liaison covalente. Elle est schématisée par un tiret entre les deux atomes.
Représenter la molécule en formule développée en schématisant les doublet liants et non liants.
📝 La théorie VSEPR⚓
Complément : 📄 Document n°2 : La théorie VSEPR
La théorie VSEPR (Valence Shell Electron Pairs Repulsion) ou en français RPECV (Répulsion des Paires Électroniques de la Couche de Valence) est une méthode destinée à prédire la géométrie des molécules. Elle énonce comme principe que les doublets liants et les doublets non liants d’un atome s’éloignent le plus possible les uns des autres pour minimiser les forces de répulsion.
Selon cette théorie, les principales géométries moléculaires sont les suivantes :
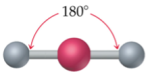 | 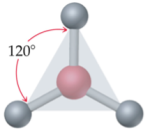 | 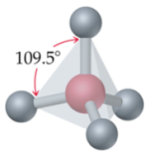 |
Linéaire | Trigonale plane | Tétraédrique |
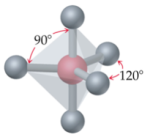 | 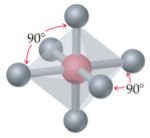 |
Bipyramide trigonale | Octaédrique |
Pour étudier et comprendre la théorie VSEPR, nous allons utiliser l’animation java « VSEPR », permettant de simuler la géométrie d’une molécule, se trouvant à cette adresse (ou via le QR-Code ci-dessous) :
 https://phet.colorado.edu/sims/html/molecule-shapes/latest/molecule-shapes_fr.html
https://phet.colorado.edu/sims/html/molecule-shapes/latest/molecule-shapes_fr.html
En fonction des besoins, le logiciel permet d’ajouter à un atome central :
des liaisons covalente simple, double ou triple, des doublets non liant ;
d'afficher l'animation en plein écran.
Lancer la simulation et explorer-la simplement quelques minutes (bouton « tout effacer » une fois terminé).
🔶 Cas où l’atome central ne possède pas de doublets non liants⚓
Soit une molécule de type \(\mathbf{AX_n}\) où l’atome central \(\ce{A}\) forme \(n\) liaisons covalentes simples, doubles ou triples avec plusieurs atomes \(\ce{X}\). L’atome \(\ce{A}\) ne possède aucun doublet non liant.
Question⚓
Q1. À l’aide du logiciel de simulation, construire les différentes molécules demandées et compléter le tableau ci-dessous. Dessiner simplement la représentation spatiale de la molécule et, en s’aidant du Doc.2, donner le nom de sa géométrie.
Formule de la molécule | \(\ce{AX2}\) | \(\ce{AX3}\) | \(\ce{AX4}\) | \(\ce{AX5}\) | \(\ce{AX6}\) |
|---|---|---|---|---|---|
Représentation spatiale |
| ||||
Géométrie |
|
Question⚓
Q2. À l’aide du modèle moléculaire, construire les différentes molécules demandées et compléter le tableau ci-dessous.
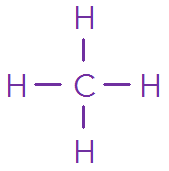
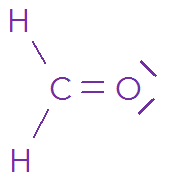
Nom de la molécule | Méthane | Dioxyde de carbone | Méthanal |
|---|---|---|---|
Formule brute | \(\ce{CH2O}\) | ||
Représentation de Lewis |
| ||
Analogie \(\mathrm{AX_n}\) | |||
Représentation spatiale |
| ||
Géométrie |
Solution⚓
Q2.
Nom de la molécule | Méthane | Dioxyde de carbone | Méthanal |
|---|---|---|---|
Formule brute | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \ce{CH4}\) | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \ce{CO2}\) | \(\ce{CH2O}\) |
Représentation de Lewis |
|
|
|
Analogie \(\mathrm{AX_n}\) | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \ce{AX4}\) | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \ce{AX2}\) | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \ce{AX3}\) |
Représentation spatiale |
| ||
Géométrie | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \textsf{Tétraédrique}\) | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \textsf{Linéaire}\) | \(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB} \textsf{Trigonale plane}\) |
🔷 Cas où l’atome central possède des doublets non liants⚓
Reprenons la molécule de type \(\ce{AX_n}\). L’atome central \(\ce{A}\) forme \(n\) liaisons covalentes simples, doubles ou triples avec plusieurs atomes \(\ce{X}\). L’atome \(\ce{A}\) possède maintenant \(p\) doublets non liants. La molécule sera alors symbolisée \(\large \mathbf{AX_nE_p}\).
Question⚓
Q3. À l’aide du logiciel de simulation, construire les différentes molécules demandées et compléter le tableau ci-dessous. Dessiner simplement la représentation spatiale de la molécule et, en s’aidant du Doc.2, donner le nom de la figure de répulsion de la molécule. La géométrie observable est la forme géométrique prise par les atomes entre eux dans l’espace.
Formule de la molécule | \(\ce{AX_2E}\) | \(\ce{AX_2E_2}\) | \(\ce{AX_2E_3}\) | \(\ce{AX_3E}\) | \(\ce{AX_3E2}\) |
|---|---|---|---|---|---|
Représentation spatiale |
| ||||
Figure de répulsion |
| ||||
Géométrie observable |
|
Question⚓
Q4. À l’aide du modèle moléculaire, construire les différentes molécules demandées et compléter le tableau ci-dessous.
Nom de la molécule | Eau | Ammoniac | Sulfure d’hydrogène |
|---|---|---|---|
Formule brute | \(\ce{H2S}\) | ||
Représentation de Lewis |
| ||
Analogie \(\mathrm{AX_nE_p}\) |
| ||
Représentation spatiale |
| ||
Figure de répulsion |
| ||
Géométrie observable |
|