📕 Définitions⚓
Définition : 📌 Le modèle du gaz parfait - [Document n°1]
Le gaz parfait est un modèle thermodynamique décrivant le comportement des gaz réels à basse pression.
Ce modèle a été développé du milieu du XVIIème siècle au milieu du XVIIIème siècle et formalisé au XIXème siècle. Il est fondé sur l'observation expérimentale selon laquelle tous les gaz tendent vers ce comportement à pression suffisamment basse, quelle que soit la nature chimique du gaz, ce qu'exprime la loi d'Avogadro, énoncée en 1811 : la relation entre la pression, le volume et la température est, dans ces conditions, indépendante de la nature du gaz.
Cette propriété s'explique par le fait que lorsque la pression est faible, les molécules de gaz sont suffisamment éloignées les unes des autres pour que l'on puisse négliger les interactions électrostatiques qui dépendent, elles, de la nature du gaz (molécules plus ou moins polaires). De nombreux gaz réels vérifient avec une excellente approximation le modèle du gaz parfait dans les conditions normales.
C'est le cas des gaz principaux de l'air, le diazote et le dioxygène.
Source : Wikipédia & https://fr.khanacademy.org
Exemple : 📑 Situations de la vie courante - [Document n°2]
Si l’on place un ballon partiellement dégonflé au soleil, on remarque qu’il reprend son volume initial et qu’il est plus dur.
Le volume d’un gaz contenu dans un ballon augmente avec la température.
La pression d’un gaz augmente avec la température.
Lorsqu’on gonfle un ballon, sa pression augmente.
Il devient plus dur. Gonfler un ballon consiste à introduire de l’air dans le ballon.
Exemple : 🧠 Rappels sur les propriétés d’un gaz - [Document n°3]
La pression d’un gaz augmente avec la quantité de matière du gaz et le volume d’un gaz augmente aussi avec la quantité de matière du gaz.
La température \(T\), le volume \(V\), la pression \(P\) et la quantité de matière \(n\) d’un gaz sont des paramètres influant sur l’état d’un gaz.
❓ Questions⚓
Question⚓
Q1. Décrire simplement ce qu’est un gaz parfait.
Solution⚓
Q1.
On appelle gaz parfait un ensemble de molécules sans interaction entre elles en dehors des chocs élastiques. Les molécules ne s’attirent ou ne se repoussent pas, elles ne font que se cogner les unes aux autres.
Les gaz parfaits ne constituent en fait qu’un modèle qui constitue bien souvent une approximation acceptable.
Question⚓
Q4. Après avoir rappelé ce que sont des grandeurs intensives, indiquer quelles variables d’états sont intensives.
Complément : 📄 Cas d’un mélange de gaz parfait / Mélange idéal - [Document n°4]
Un mélange de gaz parfait est dit idéal quand toutes les particules (qu’elles soient identiques ou non) ne subissent que des chocs élastiques et aucune autre interaction. La pression totale d’un mélange ne dépend alors pas de la nature des gaz présents, mais uniquement de la quantité totale de matière.
Question⚓
Q6. Quel est le nombre d’atome (ou d’ions, ou de molécules) identique présent dans une mole \(\left(\, 1\ \mathrm{mol} \, \right)\) de cet d’atome (ou d’ions, ou de molécules) ? Comment appelle-t-on ce nombre ?
🥼 La loi de Boyle-Mariotte : Relation entre la pression et le volume (Expérience)⚓
🏁 Mise en situation⚓
Complément : 📄 Pourquoi un paquet de chips gonfle-t-il lorsque l’altitude augmente ? - [Document n°5]

Les randonneurs et les alpinistes constatent que le volume des paquets de chips a tendance à augmenter au fur et à mesure qu’ils progressent en montagne. D’autre part, il est même délicat d’ouvrir un pot de yaourt car celui-ci devient « bedonnant » en altitude.
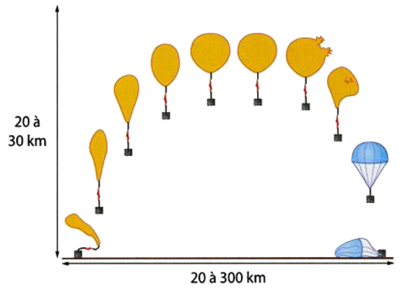
Complément : 📄 Les ballons sondes - [Document n°6]
Les ballons sondes sont utilisés en météorologie. Il s'agit d'un ballon libre non habité, utilisé pour faire des mesures de pression dans l'atmosphère grâce à des capteurs mis à bord dans une nacelle. Ils sont équipés d'un système de localisation GPS pour les suivre et donc déterminer entre autres la direction des vents.
Complément : 📄 Plongée sous-marine - [Document n°7]

Dans une bouteille de plongée, l’air est comprimé, c’est-à-dire qu’il est stocké sous grande pression. Le détendeur permet au plongeur de respirer de l’air à la même pression que celle de l’eau qui l’entoure. Cette pression de l’eau, qui augmente avec la profondeur, a une influence sur le volume des bulles d’air que le plongeur expulse en respirant.
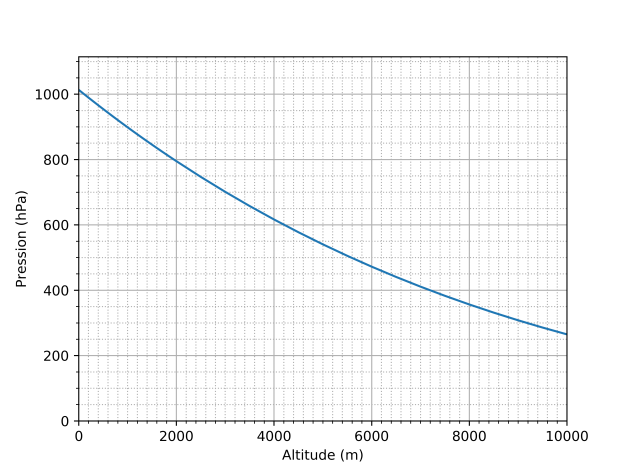
Complément : 📄 Variation de la pression en fonction de l’altitude - [Document n°8]
La pression (indiquée ici en hectopascals) est modifiée quand on s'élève en altitude. On suppose ici qu'il fait \(15\ \mathrm{^\circ C}\) au niveau de la mer, et que la pression y est de \(1013\ \mathrm{hPa}\) (valeur de la pression atmosphérique normale). Quand le temps change, la courbe change légèrement de forme.
Lire les documents n°5, 6 et 7 précédents.
📋 Prise en main de l'animation⚓
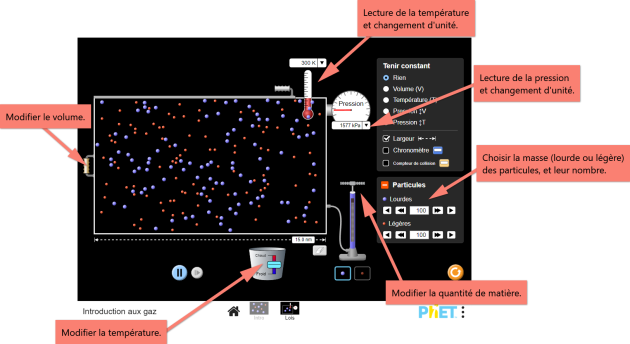
Utiliser l'animation du lien suivant et familiariser vous avec pendant 5 minutes : https://phet.colorado.edu/sims/html/gases-intro/latest/gases-intro_fr.html
Ensuite, utiliser la simulation pour répondre qualitativement aux questions suivantes :
Question⚓
Q11. Comment varie la température si la masse des particules augmente (et que l’on a le même nombre et un peu près la même vitesse moyenne pour les particules) ?
Question⚓
Q12. D’après vos connaissances, quelle forme d’énergie se calcule à partir de la vitesse et de la masse ? En déduire une définition de la température à l’échelle microscopique à partir de la moyenne d’une caractéristique des particules.
Question⚓
Q13. En changeant les unités de température trouver la relation qui existe entre les degrés Celsius et les degrés Kelvin. À quoi correspondrait le zéro absolu au niveau microscopique ?
Question⚓
Q14. La pression est l’action d’une force pressante sur une surface, qu’est-ce qui crée ici cette force qui s’exerce sur la surface des parois de l’enceinte dans laquelle se trouve le gaz. Donner une définition de la pression sur une paroi à l’échelle microscopique.
🥼 Retrouvons la loi de Boyle-Mariotte⚓
🏴 Objectif de la manipulation
On désire modéliser le comportement de l’air. Plus précisément, il s’agit de trouver une relation mathématique remarquable entre la pression \(\mathrm{P}\) et le volume \(\mathrm{V}\) d’une quantité de matière donnée \(\mathrm{n}\) d’air à température \(\mathrm{T}\) constante, lorsque celle-ci est comprimée ou détendue.
🧪 Protocole expérimental
Dans la zone « Particules », ajouter 200 particules lourdes ;
Dans l'option des paramètres constants, choisir la température ;
Déplacez le curseur du récipient aussi loin que possible vers la gauche ;
Sélectionnez la règle (« Largeur ») dans l'option des outils de mesure ;
Afficher la pression en \(\mathrm{kPa}\) ;
Mesurer la longueur du récipient (attendre que la pression se stabilise) et estimer la pression moyenne ;
Effectuez le processus ci-dessus jusqu'à ce que vous ayez une dizaines de mesures différentes et écrivez les données dans un tableau de mesure. (voir tableau ci-dessous).
Pour la suite, on admettra que le réservoir a une profondeur de \(1\ \mathrm{nm}\), ce qui fait que le volume \(V\)sera égale en valeur à la longueur \(\mathrm{L}\).
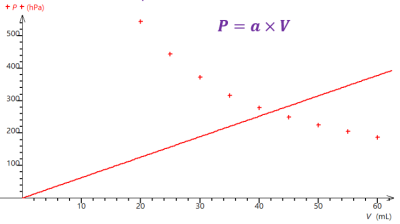
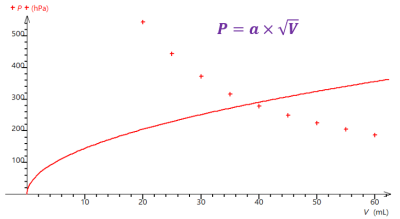
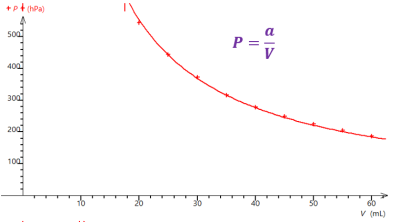
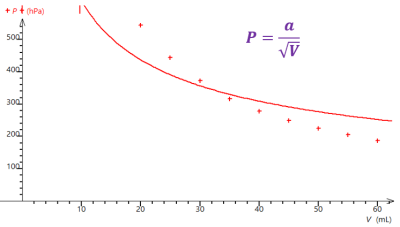
Alors, à l'aide d'un tableur-grapheur comme Regressi (ou Excel, ou LibreOffice Calc si Regressi n'est pas disponible), représentez graphiquement la pression en fonction du volume \(p=f(V)\).
Compléter ensuite les deux dernières lignes du tableau en s'aidant du tableur pour faire les calculs à votre place en une seule fois.
(Aide : Il faudra créer une grandeur calculée avec comme formule ce que vous voulez calculer.)
📏 Tableau de mesures
\(\mathrm{V\ \left(en \ m^3 \right)=L}\) | ||||||||||||
\(\mathrm{p\ \left(en\ Pa \right)}\) | ||||||||||||
\(\mathrm{\dfrac{1}{V}}\) | ||||||||||||
\(\mathrm{p\times V}\) |
Question⚓
Q18. Quelle relation (plus ou moins) simple et remarquable peut être établie entre \(P\) et \(V\) à partir des réponses faites aux questions précédentes ?
Solution⚓
Q18.
Propositions attendues :
Aide possible : utiliser l’outils modélisation pour trouver le modèle le plus adapté à nos valeurs.
Le modèle le plus adapté est \(P=\dfrac{a}{V}\) car la courbe obtenue est la plus porche de l’ensemble des valeurs expérimentales.
Complément :
💭 Cette loi sur le comportement des gaz est la loi de Boyle-Mariotte établie au XVIIème siècle par l’irlandais Robert Boyle et validée par le physicien français Edme Mariotte en 1676.
Question⚓
Observer la photographie du Doc.7 et en particulier la taille des bulles d’air expulsées par le plongeur.
Q20. Donner une explication du phénomène observé.
Solution⚓
Q20.
On constate que les bulles d’air grossissent lorsqu’elles remontent vers la surface. Or on sait que la pression de l’eau diminue lorsque la profondeur diminue. Selon la loi de Boyle-Mariotte, le produit \(P\times V\) doit rester constant. Ainsi, si la pression diminue lorsque les bulles remontent vers la surface, il est normal que leur volume augmente.
Question⚓
Q21. Les résultats obtenus lors de cette expérimentation sont-ils cohérents avec les autres documents proposés. Argumenter votre réponse. Préciser ce qu’il advient du ballon-sonde à une certaine altitude.
Solution⚓
Q21.
Doc.5 : Le volume du paquet de chips augmente car en altitude la pression diminue.
Doc.6 : Le volume du ballon-sonde augmente lorsqu’il monte dans les hautes couches de l’atmosphère car la pression diminue. Il finit même par éclater à une certaine altitude et la nacelle redescend en parachute.
✍ Application de la loi de Boyle-Mariotte à la plongée sous-marine⚓
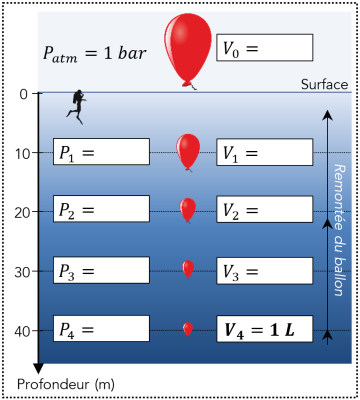
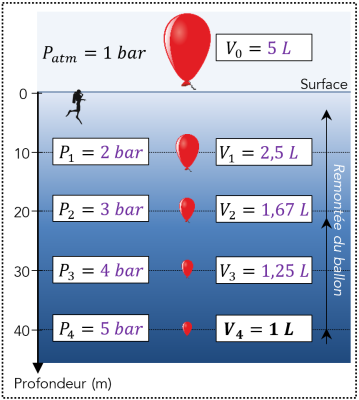
En surface, une quantité donnée d’air contenu dans les poumons d’un plongeur occupe un volume \(V_0\) à la pression \(P_0.\)
À une certaine profondeur à la pression \(P_1\), le volume de la même quantité d’air dans les poumons vaut cette fois \(V_1\).
Question⚓
Q23. Comment évolue le volume d’air enfermé dans les poumons du plongeur lorsqu’il remonte des profondeurs vers la surface ?
Question⚓
Q24. En sachant que la pression en profondeur augmente d’un bar tous les \(10\ \mathrm{m}\) et en exploitant la loi de Boyle-Mariotte, compléter le schéma ci-contre.
Q25. Expliquer pourquoi il est très dangereux pour un plongeur de remonter en bloquant sa respiration :
Q26. Que doit donc faire le plongeur lors de sa remontée ?
Solution⚓
Q24.
Q25.
Lorsque le plongeur remonte vers la surface, la pression de l’eau va diminuer. Conformément à la loi de Boyle-Mariotte, le volume d’air contenu dans ses poumons va augmenter et cela peut être très dangereux.
Q26.
Le plongeur doit expirer au cours de sa remontée pour éviter une augmentation du volume des poumons trop importante qui pourrait entraîner une déchirure pulmonaire.