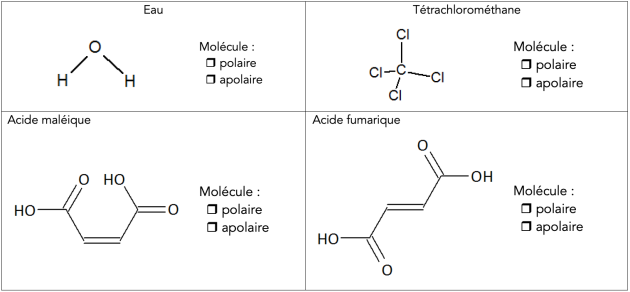
± Polarité des liaisons moléculaires⚓
Complément : 📄 Doc.1 : La liaison covalente. (Rappels)
Une liaison covalente est une liaison chimique entre deux atomes résultant de la mise en commun de deux électrons provenant séparément de chacun des deux atomes. Ces deux électrons sont appelés doublet liant.
Chaque atome d’hydrogène met en commun son électron pour former la molécule de dihydrogène.
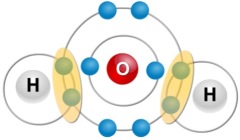
Chaque atome d’hydrogène met en commun avec l’atome d’oxygène son électron pour former la molécule d’eau.
Complément : 📄 Doc.2 : Électronégativité
L’électronégativité \(\large \mathbf{\chi}\) est une grandeur relative qui traduit l’aptitude d’un atome \(\ce{A}\) à attirer à lui le doublet liant d’électrons qui l’associe à un autre atome \(\ce{A}\) par une liaison covalente.
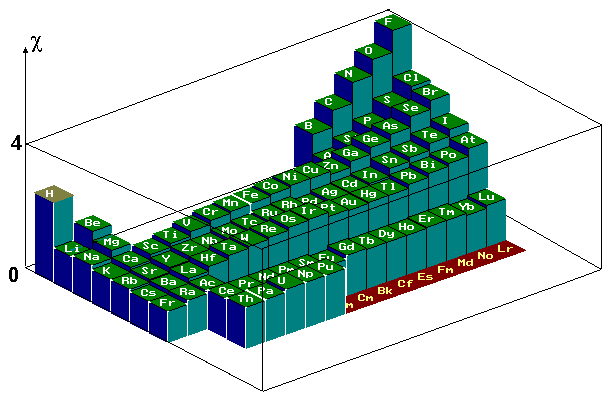
Il existe plusieurs échelles d’électronégativités Celle donnée par le chimiste Pauling est la plus utilisée.
Quelques valeurs d’électronégativité dans l’échelle de Pauling :
\(\ce{Mg}\) | \(\ce{H}\) | \(\ce{C}\) | \(\ce{N}\) | \(\ce{C\ell}\) | \(\ce{O}\) | \(\ce{F}\) |
1,31 | 2,20 | 2,55 | 3,04 | 3,16 | 3,44 | 3,98 |
Valeur relative d’électronégativité des atomes dans le tableau périodique :
Complément : 📄 Doc.3 : Les liaisons polarisées
Une liaison entre deux atomes A et B est polarisée si les électronégativités de ces deux atomes sont différentes.
La détermination de la polarisation d’une liaison \(\large \ce{A-B}\) se fait en attribuant à l’atome le plus électronégatif une charge partielle négative \(\large \mathbf{\delta^- }\) et à l’atome le moins électronégatif une charge partielle positive \(\large \mathbf{\delta^+}\). Plus la différence d’électronégativité entre les atomes liés est importante, plus la liaison est polarisée et plus les charges partielles portées par les atomes liés sont élevées.
Le moment dipolaire \(\large \mathbf{\vec{p\ }}\) permet de représenter la polarisation d’une liaison ou d’une molécule en représentant un vecteur orienté de l’atome chargé négativement vers l’atome chargé positivement.
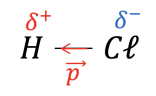
Polarisation de la liaison \(\ce{H-C\ell}\) et représentation de son moment dipolaire \(\vec{p\ }\)
Complément : 📄 Doc.4 : Les molécules polaires
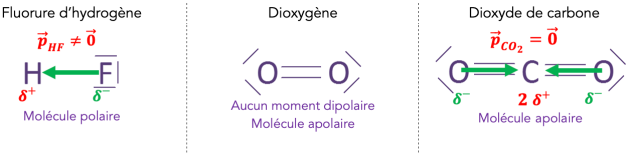
La polarité d’une molécule est la somme vectorielle de tous les moments dipolaires \(\large \vec{\ p}\) des différentes liaisons la constituant :
Si \(\vec{\ p}_\textit{molécule}\neq \vec{\ 0}\), la molécule est polaire.
Si \(\vec{\ p}_\textit{molécule} = \vec{\ 0}\), la molécule est apolaire.
Question⚓
Q1. Regarder le début de la vidéo ci-dessous. Proposer une explication à cette expérience.
Question⚓
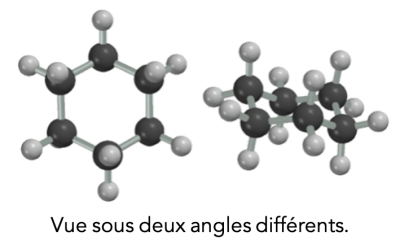
Q2. La même expérience effectuée avec un filet de cyclohexane donne un résultat négatif : le filet de cyclohexane n’est pas dévié. Proposer une explication en vous aidant du Doc.5.
Doc.5 : Molécule de cyclohexane :
Question⚓
Q4. Expliquer alors de manière plus approfondie, à l’aide des documents, le résultat de l’expérience observée dans la vidéo.
Solution⚓
Q4.
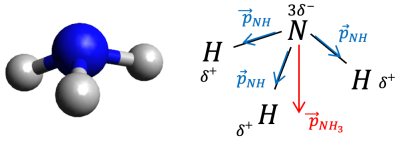
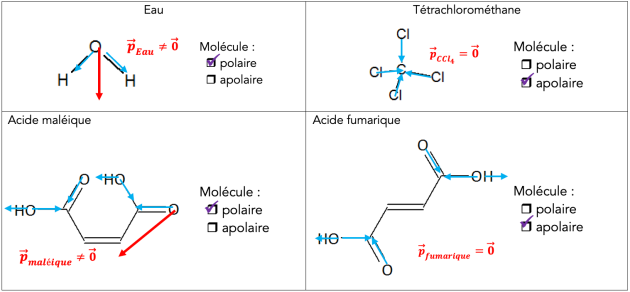
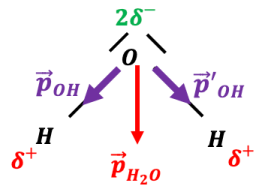
L’atome d’oxygène est beaucoup plus électronégatif que l’atome d’hydrogène, d’après le document 3 : ainsi, d’après la définition du document 3, il va attirer vers lui les doublets des deux liaisons covalentes. Il portera donc un léger excédent de charges électriques, alors que les atomes d’hydrogène auront un léger manque (on parle de déficit) de charges électriques : les liaisons \(\ce{O-H}\) sont polarisées. Il existe donc un moment dipolaire \(\large \vec{ p}_{\ce{OH}}\).
La somme des deux moments dipolaires n’est pas nulle, donc la molécule d’eau est polaire. Elle peut donc être sensible à une électrisation.
La molécule, bien qu’électriquement neutre, n’est plus symétrique du point de vue des charges et se comporte comme un « dipôle » électrostatique.
Question⚓
Q5. En raisonnant comme pour la question précédente, proposer une explication au fait que le cyclohexane ne soit pas dévié par un bâton chargé. Justifier que l’on peut considérer que la liaison \(\ce{C-H}\) est non polarisée.
Solution⚓
Q5.
D’après le Doc.5, la molécule de cyclohexane est symétrique. De plus, d’après le Doc.2, les atomes d’hydrogène et de carbone ont pratiquement la même valeur d’électronégativité (La différence d’électronégativité entre C et H est très faible : \(\Delta\chi=0,35\)) : il n’apparaît donc pas de déficit ni d’excès de charges électriques sur les atomes de cette molécule.
\(\definecolor{violetRGB}{RGB}{112, 48, 160}\color{violetRGB}\textbf{La molécule de cyclohexane est apolaire.}\)
Question⚓
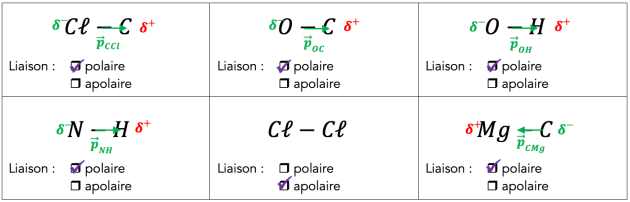
Q7. Donner, dans le tableau ci-dessous, les représentations de Lewis de l’iodure d’hydrogène, du dioxygène et du dioxyde de carbone. Indiquer les charges partielles présentes dans les molécules ainsi que les moments dipolaires des différentes liaisons.
Données : \(\large {_{1}\mathrm{H} \hspace{2em}_{6}\mathrm{C} \hspace{2em} _{8}\mathrm{O} \hspace{2em} _{9}\mathrm{F}}\)
Question⚓
Q8. Comment déterminer si la molécule est polaire ? Préciser la polarité des molécules dans le tableau précédent ?
💪 Exercice n°1⚓
💪 Exercice n°2⚓
↔️ Les interactions de Van der Waals⚓
Complément : 📄 Doc.5 : Les molécules polaires
Une molécule polaire possède une répartition inégale des électrons autour des liaisons covalentes. Une partie de la molécule sera ainsi chargée partiellement négativement et une autre positivement, on dit que la molécule se comporte comme un dipôle électrique.
Les interactions de Van der Waals sont des interactions électromagnétiques entre deux dipôles électriques. Elles sont beaucoup moins fortes (faible intensité) que les liaisons covalentes et leur portée est beaucoup plus courte que celle de l’interaction électrostatique « classique » (interaction coulombienne). Mais elles sont cependant d’une importance considérable pour expliquer la plupart des comportements des solides moléculaires dont elles assurent leur cohésion.
Complément : Documents 6 et 7
📄 Doc.6 : Exemple d’une molécule polaire, le monochlorure d’iode
📄 Doc.7 : Exemple d’une molécule apolaire formant des dipôles instantanés : le diiode
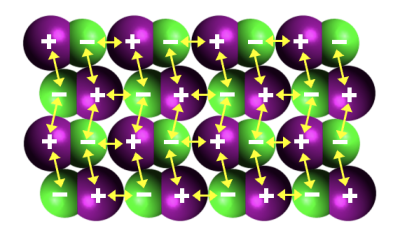
Le chlorure d’iode \(\ce{IC\ell}\) se présente, à température ambiante, sous la forme d’un liquide rouge très foncé. Sa température de fusion est \(\theta_f=13,9\ \mathrm{^\circ C}\).
La figure ci-dessous représente le chlorure d’iode solide.
La liaison \(\ce{I-C\ell} \)est polarisée car le chlore est plus électronégatif que l’iode. Dans le cristal moléculaire, les molécules s’orientent de telle manière que l’atome d’iode (pôle \(+\)) soit toujours voisin d’un atome de chlore (pôle \(-\)).
Dans les molécules de diiode \(\ce{I2}\), les liaisons covalentes entre les atomes d’iode ne sont pas polarisées. Cependant, le mouvement désordonné des électrons fait apparaître des charges partielles sur les atomes de la molécule. Ces charges variant à chaque instant, elles sont dites instantanées et les dipôles ainsi créés sont dits instantanés.
La figure ci-dessous représente les interactions entre les molécules de diiode à 2 instants différents (cas a et cas b).
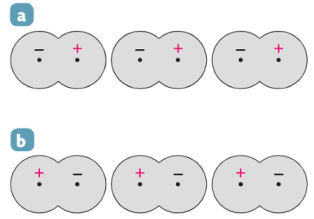
La valeur moyenne des charges instantanées est nulle, mais les effets des interactions instantanées correspondantes sont permanents.
De plus un dipôle instantané va permettre la création d’autres dipôles instantanés, par influence électrostatique.
Question⚓
Q12. Le chlorure d’iode est un cristal moléculaire constitué de la molécule \(\ce{IC\ell_{ (s) } }\). Représenter sa formule développée et indiquer les charges partielles portées par les différents atomes et tracer le moment dipolaire.
Données : \(\chi_{C\ell}=3,16 \hspace{3em} \chi_I=2,66\)

Question⚓
Q15. Le dibrome \(\ce{Br2}\) a une température de fusion de \(-7\ \mathrm{^\circ C}\), tandis que le chlorure de sodium fond à \(800\ \mathrm{^\circ C}\). Proposer une explication.
Solution⚓
Q15.
Le chlorure de sodium est un solide ionique. Sa cohésion est donc assurée par l’interaction électrostatique, dont la portée est beaucoup plus importante que celle des forces de Van der Waals. Les liaisons entre ions seront donc plus difficiles à briser que celles entre atomes de brome dans le dibrome, qui ne sont soumis qu’à l’interaction de Van der Waals, faible et à très courte portée.
À température ambiante, le diiode se sublime (il passe directement de l’état solide à l’état gazeux), comme sur cette vidéo (où un léger chauffage a permis d’accélérer la réaction) :
Impossible d'accéder à la ressource audio ou vidéo à l'adresse :
La ressource n'est plus disponible ou vous n'êtes pas autorisé à y accéder. Veuillez vérifier votre accès puis recharger le média.
Question⚓
Q16. Expliquer ce que vous avez vu.
Solution⚓
Q16.
D’après le Doc.7, la cohésion du diiode se fait grâce aux interactions de Van der Waals, qui sont très faibles et à court rayon d’action. De plus, les atomes d’iodes étant volumineux, ils interagissent peu entre eux à des distances assez courtes : au lieu de se liquéfier, le diiode se sublime.
👨🏻🏫 La liaison hydrogène⚓
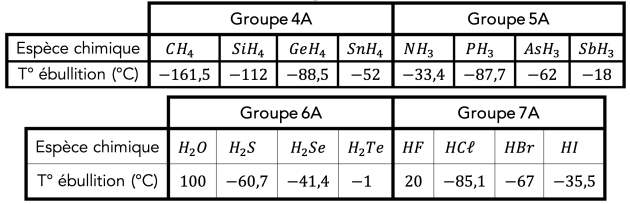
Complément : 📄 Doc.8 : Températures d’ébullition de quelques molécules
Question⚓
Q17. De quoi la température d’ébullition des molécules du groupe 4A dépend-elle ?
Solution⚓
Q17.
Au sein de la famille chimique du carbone (4ème colonne), la température d’ébullition augmente avec la masse molaire : plus les atomes sont gros et contiennent d’électrons, plus ils sont polarisables, plus les interactions de Van der Waals sont fortes entre eux, plus il faut apporter d’énergie pour les faire passer à l’état gazeux.
Question⚓
Q19 Que peut-on en déduire ?
Solution⚓
Q19.
La température d’ébullition de \(\ce{NH3}\), \(\ce{H2O}\) et \(\ce{HF}\) est plus élevée, donc ces molécules sont plus fortement liées entre elles. Il existe donc un autre type de liaisons intermoléculaires.
\(\definecolor{rougeFonceRGB}{RGB}{192, 0, 0}\color{rougeFonceRGB} \textsf{Elles sont le siège de liaisons intermoléculaires particulières : les liaisons hydrogènes.}\)
Complément : 📄 Doc.9 : La liaison hydrogène
Une liaison hydrogène est une liaison non covalente se formant entre un atome d’hydrogène et un atome très électronégatif portant un doublet non liant comme l’oxygène, l’azote ou le fluor.
La présence de liaisons hydrogène intermoléculaires (entre deux molécules différentes) renforcent la cohésion d’un solide et ses propriétés physiques sont alors plus élevées.
La liaison hydrogène est la plus forte des liaisons intermoléculaires. C’est un cas particulier des interactions de Van der Waals.
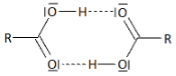
En pointillé, sont représentées les liaisons hydrogène intermoléculaire entre 2 molécules RCOOH.
Complément : 📄 Doc.10 : La liaison de la vie
La liaison hydrogène est une liaison dont peu de monde soupçonne l'importance. Pourtant, on pourrait la baptiser « la liaison de la vie », au même titre que l'on pourrait baptiser H_2O « la molécule de la vie », tellement toutes deux jouent un rôle central dans les processus biologiques au niveau moléculaire. L’eau est en effet la molécule phare pour présenter les liaisons hydrogène et ces dernières lui confère des particularités indispensables à la vie comme un point d’ébullition anormalement haut et la tendance de la glace à flotter sur l’eau liquide.
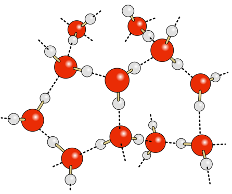
En pointillé sont représentées les liaisons hydrogène entre les molécules d’eau.
Sur le Doc.9
Question⚓
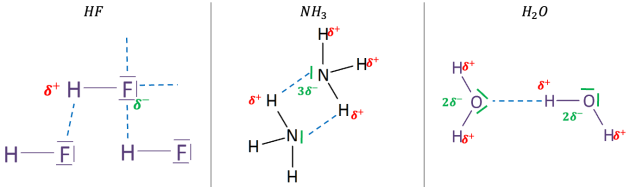
Q20. Montrer que les molécules de fluorure d’hydrogène \(\ce{HF}\), d’ammoniac \(\ce{NH3}\) et d’eau \(\ce{H2O}\) présentent des liaisons hydrogène intermoléculaires. Pour cela, on représentera les structures de Lewis des molécules et on indiquera par des pointillés les liaisons hydrogène possibles.
Données :
\(\large {_{1}\mathrm{H} \hspace{2em}_{7}\mathrm{N} \hspace{2em} _{8}\mathrm{O} \hspace{2em} _{9}\mathrm{F}}\)
\(\large \chi_N=3,04 \hspace{2em} \chi_O=3,44 \hspace{2em} \chi_F=3,98\)
Sur le Doc.10
Conclusion (📌 À SAVOIR)
📏 Distances caractéristiques et énergies de liaison⚓
Complément : 📄 Doc.11 : Quelques données

Question⚓
Q23. Justifier les faibles énergies de liaison des liaisons hydrogène et des interactions de Van Der Walls par rapport aux liaisons covalentes.
Question⚓
Q24. Quelle propriété des corps peut être expliquée avec ces énergies de liaisons faibles ?
Solution⚓
Q24.
Pour un corps qui ne possède aucune liaison de faible énergie, il pourra subir des changements d’état à faible température, car s’il avait des liaisons hydrogène ou des interactions de Van Der Waals, l’énergie de ces dernières s’ajoute à celle à fournir pour le faire changer d’état, et donc pour un corps avec ces liaisons faibles, il faudra fournir plus d’énergie pour le faire changer d’état, donc il faudra une plus forte température.