Complément : 📄 Doc.1 : La liaison métallique
Les métaux, qui forment presque les trois-quarts des éléments, sont caractérisés par une faible énergie d’ionisation et une faible électronégativité. Les électrons de valence, qui sont très peu nombreux (1, 2 ou 3), sont donc très faiblement liés au noyau de l’atome métallique.
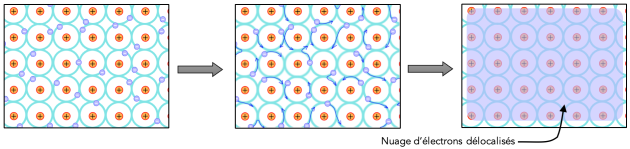
En pratique, les électrons de valence ne sont pas liés à un atome déterminé, mais ils sont délocalisés et répartis dans l’ensemble du métal. La liaison métallique est donc caractérisée par une structure d’ions positifs noyés dans un gaz d’électrons. Ce dernier assure la liaison entre les ions positifs. La liaison métallique est une liaison intense qui agit de manière identique dans toutes les directions de l’espace. Ce type de liaison favorise la création de structures cristallines simples, de grande symétrie et très compactes.
C’est la présence d’électrons mobiles qui permet d’expliquer la conductivité électrique et thermique élevée des métaux.
Complément : 📄 Doc.2 : Le modèle de la liaison métallique
Dans un métal :
Les atomes métalliques perdent, dans l’établissement de la liaison, l’influence sur leurs électrons externes :ils deviennent donc des ions positifs dont les positions, si le métal est solide, sont fixes les unes par rapport aux autres.
Les électrons externes sont délocalisés et se comportent comme s’ils étaient libres, tout en restant dans l’échantillon.
Les métaux sont connus pour leur conductivité thermique qui est très importante.
Question⚓
Q6. Expliquer pourquoi les liaisons métalliques au sein des métaux explique cette conductivité thermique.
Les métaux sont aussi de bons conducteurs électriques. Sous l’effet d’un champ électrique, même faible, on assiste au passage d’un courant.
Les métaux ne sont pas fragiles, c’est-à-dire pas « cassant ». Ceci est dû à la nature des liaisons métallique.
Question⚓
Q8. Comment appelle-t-on les deux propriétés que possède un métal qui permettent de le travailler ?
Solution⚓
Q8.
Les deux propriétés sont la malléabilité[*] et la ductilité[*].
La malléabilité est la raison pour laquelle on peut laminer (rouleau compresseur) un matériau, le forger (martèlement), ou découper facilement une faible épaisseur. L'or, l'argent et le plomb sont des métaux très malléables ou ductiles.
En résistance des matériaux, la ductilité désigne la capacité d'un matériau à se déformer plastiquement sans se rompre. La rupture se fait lorsqu'un défaut (fissure ou cavité), induit par la déformation plastique, devient critique et se propage. La ductilité est donc l'aptitude d'un matériau à résister à cette propagation. S'il y résiste bien, il est dit ductile, sinon il est dit fragile.
Complément : Remarque :
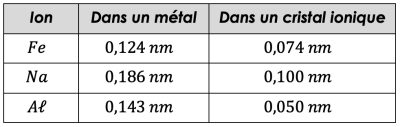
Dans un métal, les ions métalliques faisant les liaisons métalliques entre eux ont un rayon supérieur à celui d’un ion participant à une liaison ionique (cristal ionique, constitué d’ions positifs et d’ions négatifs).