Complément : Document n°1 : La constante d'acidité
Soit un couple acide-base faible \(AH_{\left(aq\right)}\ / \ A_{\left(aq\right)}^-\) associé à la réaction d'équation : \(AH_{\left(aq\right)}+H_2O_{\left(\ell\right)}\ \rightleftarrows \ A_{\left(aq\right)}^-+\ H_3O_{\left(aq\right)}^+\)
On définit une grandeur \(K_a\) sans unité appelée constante d'acidité telle que :
Il est d'usage de poser : \({\fcolorbox{blue}{white}{$\mathbf{pK_a=-\log{\ K_a}}$}}\)
Où :
\(\mathbf{K_a}\) : Constante d'acidité (sans unité)
\(\mathbf{\Big[H_3O^+\Big]}\) : concentration en ion oxonium \(\left(\mathrm{mol.L^{-1}}\right)\)
\(\mathbf{\Big[A^-\Big]}\) : concentration de la forme basique \(\left(\mathrm{mol.L^{-1}}\right)\)
\(\mathbf{\Big[AH\Big]}\) : concentration de la forme acide \(\left(\mathrm{mol.L^{-1}}\right)\)
Plus le \(pK_a\) du couple est grand (ou plus la constante d'acidité est petite), moins l'acide se dissocie dans l'eau.
En effet, plus \(\Big[AH\Big]\) est grand par rapport à \(\Big[A^-\Big]\) , plus la constante \(K_a\) est petite. Ainsi, plus le \(pK_a\) d'un acide est grand, plus cet acide est faible.
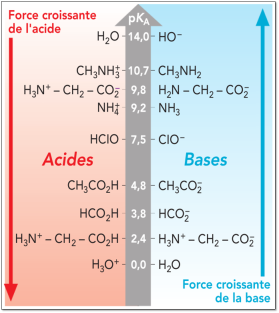
Complément : Document n°2 : Valeurs de pKa à 25°C
Méthode : Protocole expérimental
Remplir la 1ère burette de la solution d'acide éthanoïque.
Ajuster le zéro et vérifier l'absence de bulle d'air au niveau du robinet.
Remplir la 2ème burette de la solution d'ions éthanoate.
Ajuster le zéro et vérifier l'absence de bulle d'air au niveau du robinet.
Placer un bécher sous les deux burettes.
Adapter l'agitateur magnétique sous le bécher et placer le barreau aimanté.
En utilisant judicieusement les burettes, réaliser les mélanges donnés dans le tableau ci-dessous et mesurer la valeur du pH pour chacun d'eux.
Bien garder l'agitation constante.
Tableau de valeurs (à compléter)
\(V_{AH}\ \left(\ \mathrm{mL}\ \right)\) | \(25,0\) | \(25,0\) | \(25,0\) | \(25,0\) |
|---|---|---|---|---|
\(V_{A^-}\ \left(\ \mathrm{mL}\ \right)\) | \(5,0\) | \(10,0\) | \(20,0\) | \(25,0\) |
\(pH\) | ||||
\(\dfrac{V_{A^-}}{V_{AH}}\) | ||||
\(\log \left( \dfrac{V_{A^-}}{V_{AH}}\right)\) |
\(V_{AH}\ \left(\ \mathrm{mL}\ \right)\) | \(20,0\) | \(10,0\) | \(5,0\) |
|---|---|---|---|
\(V_{A^-}\ \left(\ \mathrm{mL}\ \right)\) | \(25,0\) | \(25,0\) | \(25,0\) |
\(pH\) | |||
\(\dfrac{V_{A^-}}{V_{AH}}\) | |||
\(\log \left( \dfrac{V_{A^-}}{V_{AH}}\right)\) |
Question⚓
Q1. Écrire la réaction acido-basique de l'acide éthanoïque sur l'eau.
Question⚓
Q2. En s'aidant du Doc.1, déduire l'expression du \(pH\) en fonction du \(pK_a\).
\(\large{\color{blue}\textsf{Rappels sur les log :}} \\ \\\large{\color{black}\begin{array}{ll}\log{\ (A\times B)}=\log{A}+\log{B} \ \ \ \ &\log{1}=0 \\\textsf{si } x<1 \textsf{ alors } \log{x}<0 & \textsf{si } x>1 \textsf{ alors } \log{x}>0\end{array}}\)
Solution⚓
A5-Q2.
\(pK_a=-\log{\ K_a}\)
\(pK_a=-\log{\dfrac{\Big[A^-\Big]\cdot\Big[H_3O^+\Big]}{\left[AH\right]}}\)
\(pK_a=-\log{\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}}-\log{\ \Big[H_3O^+\Big]}\)
\(pK_a=pH-\log{\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}}\)
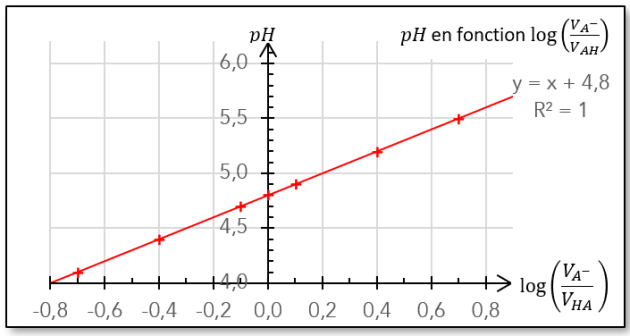
\(\color{blue}\mathbf{pH=pK_a+\log{\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}}}\)
Question⚓
Q3. Exprimer littéralement la concentration en acide \(\Big[AH\Big]\) dans le mélange, en considérant qu'aucune réaction ne se produit. (Aucun calcul numérique ne doit être réalisé ici...)
Question⚓
Q4. Démontrer alors l'égalité : \(\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}=\dfrac{V_A}{V_{AH}}\).
Solution⚓
A5-Q4.
\(\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}=\dfrac{\ \ \dfrac{C_{A^-}\times V_{A^-}}{V_{AH}+V_{A^-}}\ \ }{\dfrac{C_{AH}\times V_{AH}}{V_{AH}+V_{A^-}}}\)
\(\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}=\dfrac{C_{A^-}\times V_{A^-}}{V_{AH}+V_{A^-}}\times\dfrac{V_{AH}+V_{A^-}}{C_{AH}\times V_{AH}}\)
\(\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}=\dfrac{C_{A^-}\times V_{A^-}}{C_{AH}\times V_{AH}}\)
\(\Longleftrightarrow \color{red}\mathrm{\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}= \dfrac{V_{A^-}} {V_{AH}} }\) car \(C_{A^-}=C_{AH}=1,0\cdot{10}^{-1}\ \mathrm{mol.L^{-1}}\)
Question⚓
Q5. En utilisant le tableur de Regressi, calculer les valeurs des rapports des deux dernières lignes du tableau de valeur : \(\dfrac{\Big[A^-\Big]}{\Big[AH\Big]}\) et \(\log \dfrac{\Big[A^-\Big]}{\Big[AH\Big]}\).
Question⚓
Q7. En déduire la valeur de la constante d'acidité \(K_a\) du couple \(CH_3COOH_{\left(aq\right)}\ / \ CH_3COO_{\left(aq\right)}^-\).