Rappel : Données pour tous les exercices
Capacité thermique massique de l'eau liquide : \(c_{\text{eau}} = 4\,180 \; \mathrm{J.kg^{-1}.K^{-1}}\)
💪 Exercice n°1 : La bouilloire⚓
À l'aide d'une résistance chauffante, l'énergie électrique est convertie et fournie une quantité de chaleur. La capacité thermique de l'eau permet de connaître le temps de chauffage (la capacité thermique de la bouilloire est supposée négligeable) : pour un litre d'eau ( 1 L ) avec une bouilloire de 2,00 kW il faut une durée de 2 min 47 s pour faire monter la température de 20,0°C à 100°C.
Question⚓
Q1. Retrouver ce résultat (la durée) par une démarche calculatoire.
Donnée supplémentaire : \(\rho_{eau}=1\, 000\: g.L^{-1}\)
Solution⚓
Act.n°4 - Ex.1
Q1.
On a : \(\theta_i=20\ \mathrm{^\circ C^{-1}}\) et \(\theta_f=100\ \mathrm{^\circ C}\) et \(P=2\ kW\).
\(m_{eau}=\rho_{eau}\times V_{eau} \text{ avec } V_{eau}=1\ L\)
Comme \(c_{eau}\) est en \(\mathrm{J.kg^{-1}.^\circ C^{-1}}\), on va convertir la masse volumique : \(\rho_{eau}=1,000\ kg.L^{-1}\).
D'après ce qui a été vu précédemment, on a : \(\Delta U=Q=m\cdot c\cdot\Delta\theta\).
💪 Exercice n°2 : Détermination de la capacité thermique massique de l'huile⚓
On veut déterminer la capacité thermique massique de l'huile contenue dans un radiateur à bain d'huile.
On verse 0,5 L d'huile dans un récipient calorifugé. On plonge un thermoplongeur relié à un joulmètre et on relève la température. Celle-ci s'élève de 8°C pour une énergie fournie de 8,1 kJ.
Donnée : masse volumique de l'huile : \(\rho_{huile}=0,800\: kg.L^{-1}\).
Question⚓
Q4. Calculer la capacité thermique massique \(c_{huile}\) de l'huile.
Solution⚓
Act.4 - Ex.2
Q4.
💪 Exercice n°3 : Mur à accumulation d'énergie⚓
La température d'un mur de briques pleines exposé au soleil passe de 14°C à 35°C.
Donnée : \(c_{brique}=840\: \mathrm{kJ.kg^{-1}.^\circ C^{-1}}\).
Question⚓
Q6. La masse du mur étant de 800 kg, calculer sa variation d'énergie interne en considérant que le mur ne fait que recevoir de l'énergie du Soleil.
Solution⚓
Act.4 - Ex.3
Q6.
\(\Delta U=W+Q\)
Le mur ne fait que recevoir de l'énergie du Soleil. Donc il ne reçoit que de l'énergie thermique :
\(Q=m_{brique}\times c_{brique}\times\left(\theta_f-\theta_i\right)\)
Donc son énergie internet augmente telle que : \(\Delta U=Q=m_{brique}\times c_{brique}\times\left(\theta_f-\theta_i\right)\)
\(\Delta U=800\times840\cdot {10}^3\times\left(35-14\right)=1,4\cdot{10}^{10}\ J\ \ \ \ \ \left(\ \ =14\ GJ\ \right)\)
La nuit la température du mur passe de 35°C à 16°C en 12 heures
💪 Exercice n°4 : Utilisation d'un calorimètre pour mesurer une capacité thermique⚓
On se propose de mesurer la capacité thermique massique d'un polypropylène (PP). L'appareil de mesure utilisé est un calorimètre qui fonctionne à pression constante. Le système est parfaitement isolé.
Le conducteur ohmique placé dans le calorimètre est un fil métallique de résistance \(R=2,0\ \Omega\). Il dissipe toute l'énergie électrique qu'il reçoit sous forme d'énergie thermique grâce à l'effet Joule telle que la puissance dissipée par effet Joule vaut : \(P_{joule}=R\times I^2\).
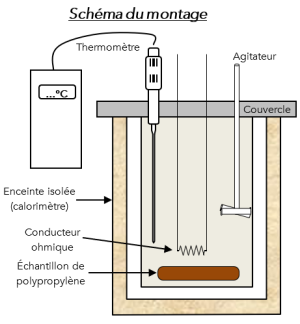
Question⚓
Q10. Quelle est la quantité d'énergie \(W_{e\ell}\) apportée par le conducteur ohmique dans le calorimètre s'il est parcouru par un courant d'intensité \(I=2,8\ A\) pendant une durée \(\Delta t=90\ s\).
On place \(m=50,0\ g\) de polypropylène dans le calorimètre à une température initiale \(\theta_0=15,0\ \mathrm{^\circ C}\).
Après un apport d'énergie \(Q=1,4\ kJ\), la température à l'intérieur du calorimètre se stabilise à \(\theta_e=28,0\ \mathrm{^\circ C}\).
Question⚓
Q11. Calculer \(Q_1\), quantité de chaleur absorbée par le calorimètre et ses accessoires, si la capacité thermique[*] du calorimètre et de ses accessoires est \(C=18\ J.K^{-1}\).
Question⚓
Q12. Établir une relation entre \(Q\), \(Q_1\) et \(Q_2\) (quantité de chaleur absorbée par l'échantillon).
Question⚓
Q13. Calculer la capacité thermique massique \(C_p\) de ce polypropylène.
Solution⚓
Act.4 - Ex.4
Q13. On a \(Q_2=c_p\times m\times\left(\theta_e-\theta_0\right)\), donc :
Question⚓
Q14. On fournit la même quantité de chaleur à deux échantillons de masses identiques, l'un en polypropylène et l'autre en acier : déterminer qualitativement l'échantillon dont la température s'élève le plus.
Donnée : Capacité thermique massique de l'acier : \(c_{acier}=0,45\ \mathrm{J.kg^{-1}.}\mathrm{^\circ C^{-1}}\).
Solution⚓
Act.4 - Ex.4
Q14. Pour élever d'un degré Celsius une masse de 1 kg de PP, il faut fournir une énergie de 1,8 kJ, alors qu'il faut fournir une énergie de 0,45 kJ pour élever d'un degré Celsius une masse de 1 kg d'acier.
L'élévation de température s'exprime ainsi : \(\Delta\theta=\dfrac{Q}{m\times c}\)
Ainsi, si on fournit la même énergie à la même masse de matière, l'élévation de température sera la plus grande pour l'échantillon qui a la plus petite capacité thermique massique.
Donc entre l'acier et le polypropylène, c'est l'acier dont la température s'élèvera le plus.
(Pour s'en convaincre, vous pouvez calculer \(\Delta\theta\) pour \(m=1\ kg\) et \(Q=1\ kJ\)).
💪 Exercice n°5 : Calorimètre⚓
Définition : Valeur en eau du calorimètre (À SAVOIR)
Dans cet exercice, en plus de chercher la capacité thermique du calorimètre, nous allons chercher également quelle masse d'eau est équivalente au calorimètre et ses accessoires, en considérant donc que le calorimètre et ses accessoires se comportent comme de l'eau : c'est ce qu'on appelle la valeur en eau[*] \(\mathbf{\mu}\) du calorimètre et de ses accessoires.
Un calorimètre contient 1 000 g d'eau à 15°C. On y verse 1 000 g d'eau à 65,5°C. La température du mélange étant à l'équilibre de 40°C.
Question⚓
Q15. Calculer la capacité thermique ainsi que la valeur en eau[*] \(\mathbf{\mu}\) du calorimètre.
Solution⚓
Act.4 - Ex.5
Q15.
Le système étudié est {Calorimètre et accessoires + eau froide + eau chaude}.
Le calorimètre et ses accessoires et l'eau froide sont à la température \(\theta_1=15\ \mathrm{^\circ C}\). L'eau chaude est à \(\theta_2=65,5\ \mathrm{^\circ C}\).
Le calorimètre reçoit de l'énergie et passe de \(\theta_1=15\ \mathrm{^\circ C}\) à \(\theta_f=40\ \mathrm{^\circ C}\) :
\(Q_1=C_{calo}\times\left(\theta_f-\theta_1\right)\)
L'eau froide de masse \(m_{froid}=1,000\ kg\) reçoit de l'énergie et passe de \(\theta_1=15\ \mathrm{^\circ C}\) à \(\theta_f=40\ \mathrm{^\circ C}\) :
\(Q_2=m_{froid}\times c\times\left(\theta_f-\theta_1\right)\)
L'eau chaude de masse \(m_{chaud}=1,000\ kg\) reçoit de l'énergie et passe de \(\theta_2=65,5\ \mathrm{^\circ C}\) à \(\theta_f=40\ \mathrm{^\circ C}\) :
\(Q_3=m_{chaud}\times c\times\left(\theta_f-\theta_2\right)\)
On considère le calorimètre comme isolé (=adabatique), donc on a : \(\Delta U=Q_1+Q_2+Q_3=0\)
Donc : \({\large { C_{calo}\times\left(\theta_f-\theta_1\right)+m_{froid}\times c\times\left(\theta_f-\theta_1\right)+m_{chaud}\times c\times\left(\theta_f-\theta_2\right)=0 }}\)
Pour déterminer la masse en eau du calorimètre, on a : \({\large {\color{red} C_{calo}=\mu\times c}}\) donc :
💪 Exercice n°6 : Encore un autre calorimètre⚓
Le vase calorimétrique d'un calorimètre est en aluminium, sa masse est \(m=50,0\ g\). On supposera ce calorimètre comme isolé (=adiabatique[*]).
Le calorimètre contient une masse d'eau de \(100\ g \; \; \left ( c_{eau} = 4,18 \cdot 10^3\ \mathrm{J.kg^{-1}.K^{-1}} \right )\), le thermomètre et les accessoires du calorimètre ont une capacité thermique de \(15,0\ \mathrm{J.K^{-1}}\).
Question⚓
Q17. Calculer la capacité thermique totale \(C\) du calorimètre et des 100 g d'eau.
Solution⚓
Act.4 - Ex.6
Q17.
La température initiale du calorimètre contenant les 100 g d'eau est \(T_1=17,2\ \mathrm{^\circ C}\). On introduit dans le calorimètre une certaine quantité d'eau \(m^\prime\) à la température \(T_2=100\ \mathrm{^\circ C}\), la température d'équilibre s'établit à \(T_e=38,5\ \mathrm{^\circ C}\).
Question⚓
Q18. Calculer la capacité thermique \(C^\prime\) de l'eau introduite. En déduire la valeur de la masse d'eau introduite.
Aide : Définir le système et les sous-systèmes, puis raisonner en partant de l'énergie que reçoit le sous-système {calorimètre et l'eau de départ}.
Solution⚓
Act.4 - Ex.6
Q18.
Le système étudié est {Calorimètre avec l'eau de départ + eau chaude}.
Le calorimètre et l'eau de départ reçoivent une énergie \(Q_1\) par transfert thermique et passe de \(T_1=17,1\ \mathrm{^\circ C}\) à \(T_e=38,5\ \mathrm{^\circ C}\) :
\(Q_1=C\times\left(T_e-T_1\right)=480\times\left(38,5-17,2\right)=10,2\cdot{10}^3\ J\)
L'eau chaude cède une énergie \(Q_2\) par transfert thermique et passe de \(T_2=100\ \mathrm{^\circ C}\) à \(T_e=38,5\ \mathrm{^\circ C}\) :
\(Q_2=C^\prime\times\left(T_e-T_2\right)\)
On suppose le calorimètre comme isolé (= adiabatique), donc sa variation d'énergie interne est nulle : \(\Delta U=0=Q_1+Q_2\)
Donc :
Or comme \({\large {C^\prime=m^\prime\times c_{eau}}}\),
on a : \({\large { m^\prime=\dfrac{C^\prime}{c_{eau}}=\dfrac{167}{{4,18\cdot10}^3} \color{blue}=4,00\cdot 10^{-2}\ \mathrm{kg}=40,0\ \mathrm{g}}}\)