💪 Exercice n°1 : Qui est qui ?⚓
Luc fait l'inventaire du laboratoire et retrouve quatre bouteilles contenant un liquide incolore. D'après l'inventaire précédent, les solutions ont toutes une concentration en soluté apporté égale à \(1,0\times 10^{-3} \ \mathrm{mol.L^{-1}}\) et contiendraient de l'acide propanoïque, de l'acide chlorhydrique, de l'hydroxyde de sodium ou du sel.
Pour les différencier, il mesure le \(pH\) et obtient : \(3,0\ ; \ 3,9\ ; \ 7,0\ ; \ 11,0\).
Question⚓
Q1. Préciser le \(pH\) des solutions d'acide chlorhydrique (acide fort) et de soude (base forte).
Solution⚓
A7-Q1.
Pour calculer le \(pH\) d'une solution d'acide fort, on peut utiliser la relation : \(pH=-\log \ C_A\).
Ainsi : \(pH=-\log \ \left( \ 1,0\times 10^{-3}\ \right)=3,0\)
Pour calculer le pH d'une solution de base forte, on peut utiliser la relation : \(pH=pK_e + \log \ C_B\).
Ainsi : \(pH=14 + \log \ \left( \ 1,0\times 10^{-3}\ \right)=11,0\)
Question⚓
Q2. Associer à chaque solution son \(pH\).
Solution⚓
A6-Q2.
D'après les calculs de la question précédente la solution de \(pH = 3,0\) correspond à l'acide chlorhydrique car c'est un acide fort.
La solution \(pH = 11,0\) correspond à l'hydroxyde de sodium car c'est une base forte.
L'acide propanoïque est un acide faible et le sel ne possède pas de propriétés acido-basiques, donc il semblerait logique que la solution d'eau salée soit la solution de \(pH = 7,0\) et que la solution d'acide propanoïque soit la solution de \(pH = 3,9\).
Question⚓
Après mélange de volumes identiques d'une solution d'acide éthanoïque et d'une solution d'éthanoate de sodium de même concentration, on obtient une solution \(S\) de \(pH=4,8\).
Q3. Préciser le nom de cette solution.
Q4. En déduire le \(pK_a\) du couple acide éthanoïque/ion éthanoate. Justifier.
Q5. Prédire l'évolution du \(pH\) si l'on ajoute un volume modéré d'acide chlorhydrique, de soude ou d'eau salée dans cette solution.
Solution⚓
A6-Q3.
Après ce mélange, on obtient une solution qui a des concentrations égales en acide éthanoïque et en sa base conjuguée, l'ion éthanoate. C'est donc une solution tampon.
A6-Q4.
Le pH d'une solution tampon est environ égal au pKA du couple qui la compose, donc le pKA du couple acide éthanoïque/ion éthanoate est environ égal à 4,8.
A6-Q5.
Une solution tampon voit son \(pH\) très peu évoluer par ajout modéré d'acide, de base ou par dilution modérée. Ainsi, dans les trois cas cités dans la question, le \(pH\) de la solution ne variera pas.
💪 Exercice n°2 : Calculer le pH d'une solution de base forte⚓
Une solution aqueuse S d'hydroxyde de sodium est préparée par dissolution totale du solide \(NaOH_{\mathrm{\left(s\right)}}\).
La solution obtenue est une solution de base forte de concentration molaire en soluté apporté \(C=5,0\cdot 10^{-2} \ \mathrm{mol.L^{-1}}\).
Question⚓
Q7. Calculer le \(pH\) de la solution S.
Solution⚓
A7-Q7.
\(pH=-\log{ \ \left[ \ce{ H3O+} \right] }\) or \(Ke=\left[ \ce{ H3O+} \right] \times \left[ \ce{ HO-} \right]\) donc : \(\left[ \ce{ H3O+} \right]=\dfrac{Ke}{\left[ \ce{ HO-} \right]}\).
On a alors : \(pH=-\log{\ \left( \dfrac{Ke}{\left[ \ce{ HO-} \right]} \right) }\)
\(pH=-\log {\ Ke}+ \log{\ \left[ \ce{ HO-} \right]}\)
\(pH=pKe+ \log{\ C}\) car la pour une base forte, la concentration en soluté apporté \(C\) est égale à \(\left[ \ce{ HO-} \right]\).
\(pH=14+\log\ { \left( 5,0\cdot 10^{-2} \right)}\)
\(\color{blue}pH=12,7\)
Question⚓
Q8. On dilue dix fois la solution S : on obtient une solution \(S^\prime\). Quel est le \(pH\) de la solution \(S^\prime\) ?
Solution⚓
A7-Q8.
Version rapide :
Lorsqu'on dilue 10 fois une solution basique, le pH diminue d'une unité pH, donc :
\(\color{blue}pH=11,7\)
Version longue :
\(\left[ \ce{ HO-} \right]^\prime =\dfrac{C}{10}=5,0\cdot 10^{-3}\ \mathrm{mol.L^{-1}}\)
\(\Rightarrow pH=14+\log\ { \left( 5,0\cdot 10^{-3} \right)}\)
\(\color{blue}pH=11,7\)
💪 Exercice n°3 : Utiliser le produit ionique de l'eau⚓
À \(37\ \mathrm{^\circ C}\), le produit ionique de l'eau vaut : \(K_e=2,4\cdot 10^{-14}\).
Question⚓
Q9. Définir le produit ionique de l'eau. (= Donner la formule.)
Question⚓
Q11. À \(37\ \mathrm{^\circ C}\), le \(pH\) de la salive vaut \(6,85\). La salive est-elle une solution acide ou basique à cette température ?
Solution⚓
A7-Q11.
Pour répondre à la question, il faut chercher le pH d'une solution neutre à \(37\ \mathrm{^\circ C}\), c'est-à-dire quand on a :\(\left[ \ce{ H3O+} \right]=\left[ \ce{ HO-} \right]\).
Or \(Ke=\left[ \ce{ H3O+} \right]\times \left[ \ce{ HO-} \right] \ \ \ \ \ \ \left( =10^{-pKe}=2,4\cdot 10^{-14} \right)\)
\(\Rightarrow \left[ \ce{ H3O+} \right]^2=Ke\)
\(\Rightarrow \left[ \ce{ H3O+} \right]=\sqrt{Ke}\)
On a donc : \(pH_\mathrm{neutre}=-\log\ {\left[ \ce{ H3O+} \right]}=-\log\ {\sqrt{Ke}}=-\log\ {\sqrt{2,4\cdot 10^{-14}}}\)
\(\color{blue}pH_\mathrm{neutre}=6,8\)
Note : il est possible d'écrire comme ceci : \(\left[ \ce{ H3O+} \right]=\sqrt{10^{-pKe}}=10^{-\frac{pKe}{2}}\)
💪 Exercice n°4 : Reconnaître deux couples acide/base⚓
 L'aniline réagit avec l'eau selon la réaction d'équation :
L'aniline réagit avec l'eau selon la réaction d'équation :
Question⚓
Q13. L'aniline est-elle un acide faible ou une base faible dans l'eau ? Expliquer.
Question⚓
Q14. Montrer que la réaction acido-basique précédente s’interprète comme l'échange d'un proton \(\ce{H+}\) entre deux espèces appartenant à deux couples acide/base différents.
Solution⚓
A7-Q14.
L'acide n°1, \(\ce{H2O}\), cède un \(\ce{H+}\) pour devenir sa base conjuguée n°1, \(\ce{HO-}\) ; et la base n°2, \(\ce{C6H5NH2}\), capte cet ion \(\ce{H+}\) pour devenir son acide conjuguée n°2, \(\ce{C6H5NH3+}\).
Il y a donc bien échange d'un proton \(\ce{H+}\) entre l'acide d'un couple et la base d'un autre couple.
💪 Exercice n°5 : Dioxyde de carbone et pH de l'eau de mer⚓
Le dioxyde de carbone \(CO_2\) est un gaz faiblement soluble dans l'eau. Les organismes marins respirent et rejettent donc du dioxyde de carbone.
De plus, une partie du dioxyde de carbone atmosphérique se dissout dans l'eau de mer.
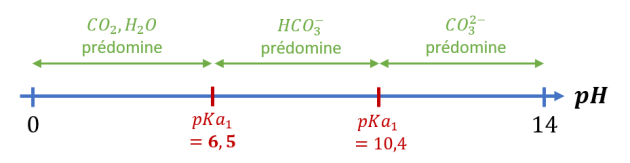
La dissolution dans l'eau du dioxyde de carbone s'accompagne de la formation d'ion hydrogénocarbonate \(HCO_{3\ \left(\mathrm{aq}\right)}^-\) qui appartient à deux couples acido-basiques :
\(CO_2,H_2O_{\left(\mathrm{aq}\right)} \ / \ HCO_{3\ \left(\mathrm{aq}\right)}^-\hspace{10mm} \left(\ pK_{a1} \ \right)\)
\(HCO_{3\ \left(\mathrm{aq}\right)}^- \ / \ CO_{3\ \left(\mathrm{aq}\right)}^{2-}\hspace{10mm} \left(\ pK_{a2} \ \right)\)
L'eau de mer contient donc, entre autres, les espèces chimiques suivantes : \(CO_2,H_2O_{\left(\mathrm{aq}\right)}\), \(HCO_{3\ \left(\mathrm{aq}\right)}^-\) et \(CO_{3\ \left(\mathrm{aq}\right)}^{2-}\).
Question⚓
Q15. Écrire l'équation de la réaction du dioxyde de carbone dissous avec l'eau, puis la relation entre le \(pH\) et le \(pK_{a1}\)
Solution⚓
A7-Q15.
\(\large { \ce{CO2,H2O + H2O \ \rightleftarrows \ HCO3- + H3O+}}\)
\(pH=pKa+\log\ {\dfrac{\left[ \ce{A-} \right]}{ \left[ \ce{AH} \right]}}\) ( voir Activité n°4, p.8 )
\(pH=pKa_1+\log\ {\dfrac{\left[ \ce{HCO3-} \right]}{ \left[ \ce{CO2,H2O} \right]}}\)
Question⚓
Q16. Écrire l'équation de la réaction de l'ion hydrogénocarbonate avec l'eau, puis la relation entre le \(pK_{a1}\) et le \(pK_{a2}\).
Proportions des espèces
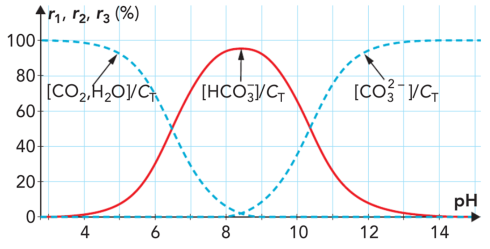
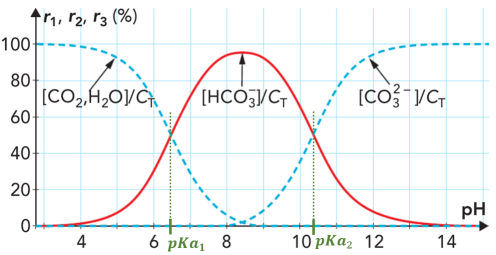
Le graphe ci-dessus, représente, à \(25\ \mathrm{^\circ C}\), les variations de trois rapports en fonction du \(pH\) :
\(r_1=\dfrac{\Big[CO_2,H_2O \Big]}{C_T}\), \(r_2=\dfrac{\Big[HCO_{3}^- \Big]}{C_T}\) et \(r_3=\dfrac{\Big[CO_{3}^{2-} \Big]}{C_T}\)
avec \(C_T=\Big[CO_2,H_2O \Big]+\Big[HCO_{3}^- \Big]+\Big[CO_{3}^{2-} \Big]\) qui représente donc la concentration totale de ces 3 espèces dans l'eau.
Le \(pH\) idéal de l'eau de mer est voisin de 8,2 à \(25\ \mathrm{^\circ C}\). Or l'augmentation du dioxyde de carbone atmosphérique provoque une diminution du \(pH\) de l'eau de mer qui pourrait être égal à 7,8 à la fin du XXIe siècle.
Question⚓
Q19. Quel est l'effet de cette « acidification des océans »
sur les organismes qui construisent leur coquille ou leur squelette à partir du carbonate de calcium \(CaCO_{3\ \left(\mathrm{s}\right)}\) ?
Solution⚓
A7-Q19.
L'acidification des océans provoquera une baisse du pH de l'eau à cause de la dissolution du dioxyde de carbone Cela va provoquer une réaction chimique entre \(\ce{CaCO3}\) et \(\ce{H3O^+}\), ce qui va donc consommer le \(\ce{CaCO3}\) formant la coquille ou le squelette des organismens marins.